Tumor suppressor genes and the tumor microenvironment in hepatocellular carcinoma
Liver cancer is the third most common cause of cancer related death worldwide and more than 85% of liver carcinomas are hepatocellular carcinomas (HCC). The high mortality rate of HCC is mainly caused by metastasis or by de novo tumor formation in the diseased liver. Thus, liver inflammation, fibrosis and cirrhosis are the most important contributors to HCC development and progression. One of the key pathways is the interleukin-6 signaling pathway which facilitates the interplay between infiltrating immune cells and tumor cells in the tumor microenvironment of the liver. Although significant progress has been made in the HCC field, the molecular mechanisms and signaling pathways underlying HCC development and progression are still poorly understood. To better understand this aggressive tumor type, we are using cohort-based multi omics approaches, cell culture-based analyses and animal experiments.
We found that chromosome 8p, which exhibits the highest frequency (45%) of genomic copy number loss, is associated with poor outcome (Roessler et al. Gastroenterology 2012). In addition, we also identified tumor suppressor genes SORBS3 and SH2D4A on chromosome 8p. Interestingly, the gene expression profiles of patients with chromosome 8p deletion are characteristic of the inhibition of interleukin-6 (IL-6) signal transduction (Ploeger et al. Hepatology, 2016). IL-6 signaling plays a crucial role in the tumor microenvironment by promoting inflammation, tumor development and metastasis. Therefore, we investigated the role of chromosome 8p genes in IL-6 signaling and could demonstrate that the tumor suppressor genes SH2D4A and SORBS3 collaborate to inhibit STAT3/IL-6 signaling in HCC cells. Currently, we are seeking to identify essential genes in chromosome 8p deficient HCC cells which may be represent vulnerabilities of these tumors.
Integration of multi-omics data and cohort-based analyses in cholangiocarcinoma
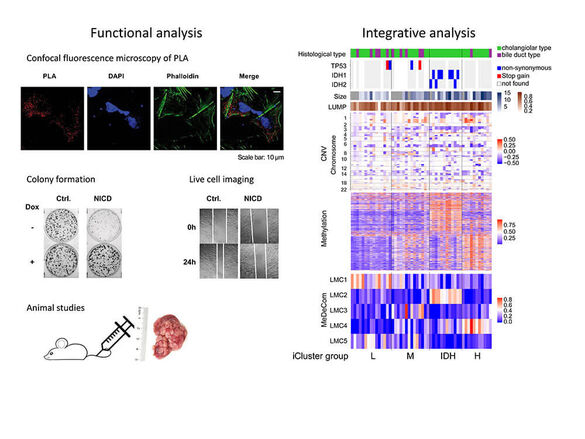
Cholangiocarcinoma (CCA) is a rare, highly aggressive and often fatal tumor of the bile ducts. According to their anatomical location, CCAs are classified as intrahepatic (iCCA), perihilar (pCCA) and distal CCA (dCCA). Cholelithiasis, primary sclerosing cholangitis (PSC), infection with the liver fluke parasites O. viverrini or C. sinensis have been described as risk factors in CCA. Our current research focuses on the molecular profiling of CCA using DNA methylation microarrays and genomic sequencing to identify patient subgroups. Recently, we were able to show that in intrahepatic CCA, four prognostically relevant patient subgroups can be distinguished by the integration of DNA methylation, genomic alterations, and mutations (Goeppert, Toth et al. Hepatology, 2019). Furthermore, we demonstrated that PSC-associated CCA show a distinct extrahepatic morpho-molecular phenotype, independent of the anatomical location of the tumor (Goeppert, Folseraas, Roessler et al. Hepatology, 2020). To pinpoint the development of CCA, we are delineating early precursor lesions and aim at identifying the cell-of-origin of CCA subgroups (Goeppert et al. Gut, 2021).
Development and progression of gallbladder carcinoma
Biliary tract cancer comprises gallbladder cancer (GBC) and cholangiocarcinoma (CCA). Overall GBC is a rare tumor entity with a prevalence of 2 per 100,000. However, in Native Americans the incidence is much higher with 23 per 100,000. General risk factors for GBC include female gender, age, ethnicity, genetic predisposition, cholelithiasis, chronic inflammation of the gallbladder and obesity. Due to the low prevalence in Western countries only very few studies on GBC exist. However, the low 2-year survival rate of less than 10% underpins the need for a better understanding for this disease. Therefore, we are using profiling technologies and cell culture systems to identify deregulated pathways in a well characterized cohort of GBC patients.
Selected publications
Selected publications
- Goeppert B, Stichel D, Toth R, Fritzsche S, Loeffler MA, Schlitter AM, Neumann O, Assenov Y, Vogel MN, Mehrabi A, Hoffmann K, Köhler B, Springfeld C, Weichenhan D, Plass C, Esposito I, Schirmacher P, von Deimling A, Roessler S. Integrative analysis reveals early and distinct genetic and epigenetic changes in intraductal papillary and tubulopapillary cholangiocarcinogenesis. Gut, online ahead of print. doi: 10.1136/gutjnl-2020-322983. IF: 23.059
- Ploeger C*, Huth T*, Sugiyanto RN, Pusch S, Goeppert B, Singer S, Tabti S, Hausser I, Schirmacher P, Désaubry L, Roessler S. Prohibitin directly interacts with the tumor suppressor gene SH2D4A and with STAT3 and exerts a crucial role in hepatocellular carcinoma. Cell Death Dis. 2020 11:1023. PMID: 33257655. IF: 8.469
- Goeppert B*, Folseraas T*, Roessler S*, Kloor M, Volckmar AL, Endris V, Buchhalter I, Stenzinger A, Grzyb K, Grimsrud MM, Gornicka B, von Seth E, Reynolds GM, Franke A, Gotthardt DN, Mehrabi A, Cheung A, Verheij J, Arola J, Mäkisalo H, Eide TJ, Weidemann S, Cheville JC, Mazza G, Hirschfield GM, Ponsioen CY, Bergquist A, Milkiewicz P, Lazaridis KN, Schramm C, Manns MP, Färkkilä M, Vogel A; International PSC study group, Boberg KM, Schirmacher P, Karlsen TH. Genomic characterization of cholangiocarcinoma in primary sclerosing cholangitis reveals novel therapeutic opportunities. Hepatology. 2020 Oct;72(4):1253-1266. PMID: 31925805. IF: 17.425
- Luiken S, Fraas A, Bieg M, Sugiyanto R, Goeppert B, Singer S, Ploeger C, Warsow G, Marquardt J, Sticht C, De La Torre C, Pusch S, Mehrabi A, Gretz N, Schlesner M, Eils R, Schirmacher P, Longerich T, Roessler S. NOTCH target gene HES5 mediates oncogenic and tumor suppressive functions in hepatocarcinogenesis. Oncogene. 2020 Apr; 39(15):3128–3144. PMID: 32055024. IF: 9.867
- Goeppert B, Toth R, Singer S, Albrecht T, Lipka DB, Lutsik P, Brocks D, Baehr M, Muecke O, Assenov Y, Gu L, Endris V, Stenzinger A, Mehrabi A, Schirmacher P, Plass C, Weichenhan D*, Roessler S*. Integrative analysis defines distinct prognostic subgroups of intrahepatic cholangiocarcinoma. Hepatology. 2019 May;69(5):2091-2106. PMID: 30615206. IF: 17.425
- Ploeger C, Waldburger N, Fraas A, Goeppert B, Pusch S, Breuhahn K, Wang XW, Schirmacher P, Roessler S. Chromosome 8p tumor suppressor genes SH2D4A and SORBS3 cooperate to inhibit interleukin-6 signaling in hepatocellular carcinoma. Hepatology. 2016 Sept;64(3):828-42. PMID: 27311882. IF: 17.425
Full list of publications
https://pubmed.ncbi.nlm.nih.gov/?term=Roessler+Stephanie+OR+R%C3%B6ssler+Stephanie&sort=date
Funding
DFG (German Research Foundation)
Deutsche Krebshilfe (German Cancer Aid)
PSC Partners Seeking a Cure
Wilhelm Sander-Stiftung
NCT Heidelberg School of Oncology
Collaborations
Prof. Mathias Heikenwälder (DKFZ, Heidelberg)
Prof. Tom H. Karlsen (Norwegian PSC Research Centre, Oslo)
Prof. Josep M Llovet (IDIBAPS, Barcelona and Icahn School of Medicine at Mount Sinai, USA)
Prof. Christoph Plass and Dr. Reka Toth (DKFZ)
Dr. Carsten Sticht (Zentrum für Medizinische Forschung, Mannheim)
Dr. Xin Wei Wang (National Cancer Institute, Bethesda, MD, USA)
Group members


PD Dr. Stephanie Roessler (Group Leader)
Dr. Thomas Albrecht (Physician)
Alphonse Charbel (MD student)
Eva Eiteneuer (Technician)
Angelika Fraas (Technician)
Sarah Fritzsche (Postdoc)
Thorben Huth (PhD student)
Aslihan Inal (PhD student)
Raisatun Nisa Sugiyanto (PhD student)
Core Facility
PD Dr. Stephanie Roessler leads the section Laser microdissection (LMD). For more details please visit:
Technologieplattform Lasermikrodissektion