BEDEUTUNG DER EKTOPEN EXPRESSION DES AKTIN-BINDENDEN PROTEINS L-PLASTIN FÜR DIE MIGRATION, INVASION UND METASTASIERUNG VON TUMORZELLEN
oder: wie Krebszellen von Immunzellen das Wandern lernen
Nur wenige Patienten sterben an den Folgen eines Primärtumors. Dieser lässt sich in der Regel entfernen oder zerstören. Das weitaus größere Problem sind im Körper verstreute Tumorabsiedlungen (Metastasen). Metastasen können in ungünstigen Fällen bereits präoperativ vorliegen. Sie treten jedoch häufig auch erst postoperativ, teilweise nach vielen Jahren, auf. Daher ist es ein vorrangiges Anliegen, molekulare Mechanismen aufzuspüren, welche die Tumorzellen in die Lage versetzen, aus dem Zellverband des Primärtumors auszuwandern und Zellabsiedelungen auszubilden. Sind diese Mechanismen bekannt, so ergeben sich neue therapeutische Ansatzpunkte zur peri- und postoperativen Verhinderung der Tumorzellmetastasierung.
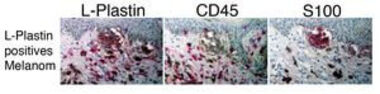
Tumorzellen verwenden zur Metastasierung ähnliche Mechanismen der Zellwanderung (Migration) wie professionell migrierende Zellen, zu denen insbesondere die Zellen des Immunsystems zählen (Klemke et al. 2007). Der Umbau des Aktin-Zytoskeletts ist entscheidend an Vorgängen der Migration beteiligt. Daher stellen Aktin-bindende Proteine, die den Umbau des Aktin-Zytoskeletts vermitteln, mögliche Angriffspunkte dar, um die invasiven Eigenschaften von Tumorzellen negativ zu beeinflussen. Ein interessanter Kandidat ist das Aktin-bindende Protein L-Plastin, von dem wir wissen (s.o.), dass es in Leukozyten durch Stimulation verschiedener Oberflächenrezeptoren modifiziert (phosphoryliert) wird (Wabnitz et al. 2007) und an Vorgängen der Adhäsion und Migration beteiligt ist. Die Expression von L-Plastin ist normalerweise auf hämatopoetische Zellen beschränkt. Hier spielt es u.a eine Rolle bei der Integrin-vermittelten Zellmigration. In Zusammenarbeit mit der Abteilung Dermatologie und dem Institut für Pathologie des Universitätsklinikums Heidelberg haben wir immunhistologische Analysen an Tumormaterial aus Melanom-Patienten durchgeführt und festgestellt, dass 25% der humanen malignen Melanome ektop L-Plastin exprimieren (Abb. 5).
ABB. 5
Abb. 5: Expression von L-Plastin im malignen Melanom.
Benachbarte histologische Schnitte eines malignen Melanoms wurden mit Antikörpern gegen L-Plastin, den Leukozytenmarker CD45 (um eingewanderte L-Plastin-positive Leukozyten von L-Plastin-positiven Tumorzellen zu unterscheiden) und dem Melanom-Marker S100 angefärbt.
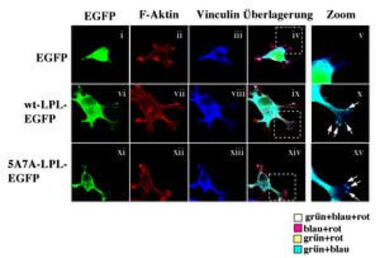
Über eine siRNA vermittelte Hemmung der L-Plastin Expression in Melanomzellen konnten wir deren Migration und Invasivität in vitro blockieren (Klemke et al. 2007; Samstag et al. 2007). Umgekehrt führt eine cDNA vermittelte Expression von L-Plastin in L-Plastin negativen Melanomzellen zu verstärkter Migration, indem die Ausbildung Vinculin-haltiger Adhäsionsstellen gefördert wird (Abb. 6).
ABB. 6
Abb. 6: L-Plastin fördert die Ausbildung Vinculin-haltiger Adhäsionsstellen (Podosomen).
MV3 Melanomzellen, die entweder cDNA kodiertes EGFP, Wildtyp-L-Plastin-EGFP (wt-LPL-EGFP) oder nicht-phosphorylierbares 5A7A-L-Plastin-EGFP (5A7A-LPL-EGFP) (grün) exprimieren, wurden auf Matrigel (Basalmembran)-beschichtete Deckgläschen ausgesät. Nach einer Stunde wurden die Zellen fixiert, permeabilisiert und mit Phalloidin-TRITC (F-Aktin, rot) und einem monoklonalen Vinculin-Antikörper (Vinculin, blau) angefärbt und mittels konfokaler Laserscanning-Mikroskopie untersucht. Gezeigt ist eine repräsentative optische x-y-Ebene auf Höhe des Deckgläschens. Bei der Zellwanderung bilden Melanomzellen Vinculin-haltige Fortsätze aus. L-Plastin reichert sich – unabhängig vom Phosphorylierungszustand - in diesen Zellfortsätzen an und verstärkt deren Ausbildung. Die gestrichelten Rechtecke in den Überlagerungen zeigen die Bereiche der rechts dargestellten Vergrößerungszonen (Zoom) an. Die Pfeile weisen auf Ko-Lokalisierung von wt-L-Plastin und 5A7A-L-Plastin mit Vinculin in den Zellfortsätzen hin.
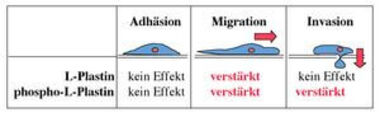
Interessanterweise wird die Invasivität der Melanomzellen in die Basalmembran nur durch phosphorylierbares L-Plastin verstärkt, nicht jedoch durch die Expression einer nicht-phosphorylierbaren L-Plastin Mutante (Abb. 7). Kürzlich konnten wir in einem in vivo Maus-Tumormodell beweisen, dass das Vorhandensein von phosphoryliertem L-Plastin in Tumorzellen tatsächlich zu deren verstärkten Metastasierung im Körper führt. Das Ausmaß der Metastasierung konnten wir durch den Einsatz von shRNA, die die Produktion von L-Plastin in den Tumorzellen in vivo einschränkt, deutlich vermindern (Riplinger et al. 2014).
ABB. 7
Abb. 7: Funktionelle Auswirkungen der Expression und Phosphorylierung von L-Plastin in humanen Melanomzellen.
Die Expression von L-Plastin – sowohl der phosphorylierten (phospho-L-Plastin) als auch der nicht-phosphorylierten Form (L-Plastin) – haben keinen Effekt auf die Adhärenz der Tumorzellen an Komponenten der extrazellulären Matrix (links). Jedoch wird die Migration der Melanomzellen verstärkt (Mitte), wenn L-Plastin exprimiert wird. Die Invasion der Melanomzellen in die Basalmembran (rechts) wird zusätzlich erhöht, wenn das ektop exprimierte L-Plastin in den Tumorzellen phosphoryliert wird.