- Arbeitsgruppen
- Klinisches Studienzentrum
- Sektion Kardio-Onkologie
- Section of Molecular and Translational Cardiology
- Klaus-Tschira-Institut für Computerkardiologie
- Heisenberg Professur für Immunkardiologie (W3)
- Jun. Professur für Künstliche Intelligenz in der Kardiovaskulären Medizin
- Pregnancy Heart Team: Kardiologie der Schwangerschaft
- DZHK-Standort Heidelberg/Mannheim
- Heidelberg CardioBiobank (HCB)
- Scientific Management and Coordination Unit (SMCU)
AG Ionenkanal-Signalkomplexe
Übersicht
Die Ionenkanäle der Herzmuskelzelle liegen nicht als einzelne Proteine vor, sondern bilden Signalkomplexe zusammen mit spezifischen Signalmolekülen. Bei Kardiomyopathien kommt es im Rahmen des Remodelings zu gravierenden strukturellen und funktionellen Veränderungen dieser Signalkomplexe, welche die Entstehung von Arrhythmien entscheidend begünstigen. Ziel unserer Forschung ist es, neue molekulare Zielstrukturen innerhalb bestimmter Signalkomplexe zu identifizieren und für die antiarrhythmische Therapie zu validieren.
Die gegenwärtigen Projekte fokussieren sich dabei molekular auf Signalkomplexe der Kir2-Kanäle (DFG gefördert), die den IK1 Strom bilden, und des Aquaporin-1 Kanals (DFG gefördert in Kooperation mit der Nephrologie), des einzigen kardiomyozytären Wasserkanals. In einer innovativen interdisziplinären Kooperation mit der Neuroonkologie am DKFZ untersuchen wir Kir2-Signalkomplexe vergleichend im ZNS (Medulloblastom) und im Herzmuskel (Förderung durch Exzellenzcluster-Initiative).
Team
Arbeitsgruppenleiter
Wiss. Mitarbeiter
Medizinische Doktoranden/-innen
-

Sebastian Fried
-

Nicolai Ritschel
Projekte
Adrenerge Regulation des kardialen IK1 Stromes
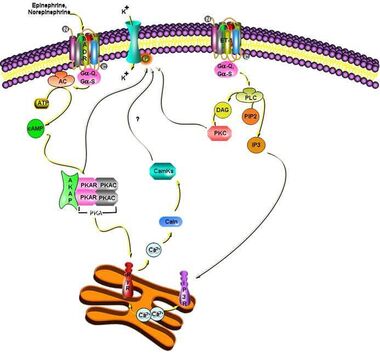
Die Down- Regulation des einwärts gleichrichtenden IK1 Stromes ist ein Marker für das elektrische Remodeling bei der Herzinsuffizienz und führt zu ventrikulären Arrhythmien. Wir konnten zeigen dass bestimmte arrhythmogene katecholaminerge Signalwege bei der Herzinsuffizienz eine Inhibition des kardialen IK1 Stromes verursachen. Dies geschieht über eine direkte Phosphorylierung der zugrundeliegenden Kanaluntereinheiten. Mithilfe transgener Techniken und spezieller Knock-out Mäuse arbeiten wir derzeit an der Identifikation des genauen molekularen Wirkmechanismus, um neue potentielle Zielstrukturen für die antiarrhythmische Therapie downstream von kardialen Adrenorezeptoren zu evaluieren.
Förderung durch DFG Mittel und die Medizinische Fakultät (Postdoc Programm).
Die Ca2+ Homöostase im kardialen Purkinje System und deren Rolle bei der Entstehung fokaler ventrikulärer Arrhythmien bei der Herzinsuffizienz
Neue Erkenntnisse in der Pathophysiologie von fokalen ventrikulären Arrhythmien haben die Dysregulation der Ca2+ Homöostase und damit verbunden bestimmte elektrophysiologische Veränderungen in den Purkinjefasern in den Fokus der Aufmerksamkeit gerückt. Basierend auf dem differentiellen Expressionsprofil kardialer Purkinjefasern verglichen zum Arbeitsmyokard, ist
es inzwischen möglich mittels transgener Techniken spezifisch mit Purkinjefasern zu arbeiten.
In diesem Kooperationsprojekt (mit der AG Myokardiale Epigenetik), werden aktuell transgene Mausmodelle mit spezifischer Expression bzw. konditionalem Knock-out im Purkinje System generiert. Diese Modelle sollen vergleichend evaluiert werden im Hinblick auf ihre elektrophysiologischen Eigenschaften nach herbeigeführter Herzinsuffizienz.
Eine DFG Förderung für dieses Projekt wird in 2013 beantragt.
Autoimmune Mechanismen in der Pathogenese idiopathischer Reizbildungs- und Reizleitungsstörungen
Pathogenese, Progression und damit auch die Prognose einer Herzinsuffizienz werden durch Autoantikörper wesentlich modifiziert. Die durch eine primäre Herzschädigung an die Komponenten des Immunsystems präsentierten Antigene induzieren dabei bei entsprechender Disposition eine Immunantwort, die eine weitere Gewebeschädigung induzieren kann. Eine besonders ausgeprägte Assoziation zwischen dem Auftreten von Autoantikörpern und dem klinischen Phänotyp wurde bei der chronischen Herzinsuffizienz beobachtet. In Zusammenarbeit mit der Arbeitsgruppe von Prof. Kaya gelang kürzlich der kausale Nachweis einer durch Autoantikörper induzierten Reizleitungsstörung. Durch spezifische Immunisierung von Ratten gegen den kardialen Natriumkanal Nav1.5 konnten AV-Blockierungen und Sinusarreste provoziert werden. Bei einem Patientenkollektiv aus unserer Schrittmacherambulanz mit höhergradigem AV-Block und strukturell unauffälligem Herzen konnten ferner Autoantikörper gegen kardiale Proteine aus
dem Serum isoliert werden, unter anderem gegen Nav1.5, die bei gesunden Kontrollprobanden nicht nachweisbar waren. Basierend auf diesen Ergebnissen ist eine weitere Charakterisierung autoimmuner Mechanismen in der Pathogenese von Reizleitungsstörungen geplant. Eine DFG Förderung für dieses Kooperationsprojekt wird 2014 beantragt.
Die Regulation von endothelialen und myokardialen Aquaporin-1 Kanälen

Aquaporin-1 Kanäle sind funktionell dominante Wasserkanäle in einigen Endothelien und in Kardiomyozyten. Von verwandten Aquaporinen wurde gezeigt, dass sie die Ionen- Homöostase bestimmen und damit die elektrischen Eigenschaften von erregbaren Zellen modulieren können. Wir konnten kürzlich zeigen, dass die Aquaporin-1 Funktion stark durch die Proteinkinase C reguliert wird und dass diese Regulation von funktioneller Bedeutung in Nativzellen ist. Daraufhin haben wir eine gefloxte Aquaporin-1 Knock-out Maus generiert mit deren Hilfe wir pathophysiologische Studien durchführen können. Zurzeit werden Vorbereitungen getroffen um diese Mäuse nun mit anderen Mäusen zu kreuzen um konditionale Knock-outs in spezifischen Endothelien und im Myokard zu generieren. Diese Modelle werden dann weiter charakterisiert werden, u. a. in einem experimentellen Peritonealdialyse Modell und in einem Sepsis Modell (endothelialer Knock-out) und durch kardiale und elektrophysiologische Phänotypisierung (myokardialer Knock-out).
Förderung durch DFG Mittel
Wissenschaftliche Methoden
Zelluläre und molekulare Elektrophysiologie, Biochemie, hochauflösende Mikroskopie (in Kooperation mit dem Kirchhoff-Institut für Physik), transgene Tiermodelle.
Repräsentative Publikationen
Korkmaz S, Zitron E, Bangert A, Seyler C, Li S, Hegedüs P, Scherer D, Li J, Fink T, Schweizer PA, Giannitsis E, Karck M, Szabó G, Katus HA, Kaya Z. Provocation of an autoimmune response to cardiac voltage-gated sodium channel NaV1.5 induces cardiac conduction defects in rats. J Am Coll Cardiol 62: 340 - 9 (2013)
Zitron E, Günth M, Scherer D, Kiesecker C, Kulzer M, Bloehs R, Scholz EP, Thomas D, WeidenhammerC, Kathöfer S, Bauer A, Katus HA, Karle CA: Kir2.x inward rectifier potassium channels are differentially regulated by adrenergic a1A receptors. J Mol Cell Cardiol 44: 84 - 94 (2008)
Zhang W, Zitron E, Hömme M, Kihm L, Morath C, Scherer D, Hegge S, Thomas D, Schmitt CP, Zeier M, Katus H, Karle C, Schwenger V: Aquaporin-1 channel function is positively regulated by protein kinase C. J Biol Chem 29: 20933 - 40 (2007)
Kiesecker C, Zitron E, Scherer D, Lueck S, Bloehs R, Scholz EP, Pirot M, Kathöfer S, Thomas D, Kreye VA, Kiehn J, Borst MM, Katus HA, Schoels W, Karle CA: Regulation of cardiac inwardly rectifying potassium current IK1 and Kir2.x channels by endothelin-1. J Mol Med 84(1): 46 - 56 (2006)
Zitron E, Scholz EP, Owen RW, Lück S, Kiesecker C, Thomas D, Kathöfer S, Niroomand F, Kiehn J, Kreye VA, Katus HA, Schoels W, Karle CA: QTc prolongation by grapefruit juice and its potiential pharmacological basis: HERG channel blockade by flavonoids. Circulation 111: 835-838 (2005)
- Arbeitsgruppen
- Klinisches Studienzentrum
- Sektion Kardio-Onkologie
- Section of Molecular and Translational Cardiology
- Klaus-Tschira-Institut für Computerkardiologie
- Heisenberg Professur für Immunkardiologie (W3)
- Jun. Professur für Künstliche Intelligenz in der Kardiovaskulären Medizin
- Pregnancy Heart Team: Kardiologie der Schwangerschaft
- DZHK-Standort Heidelberg/Mannheim
- Heidelberg CardioBiobank (HCB)
- Scientific Management and Coordination Unit (SMCU)