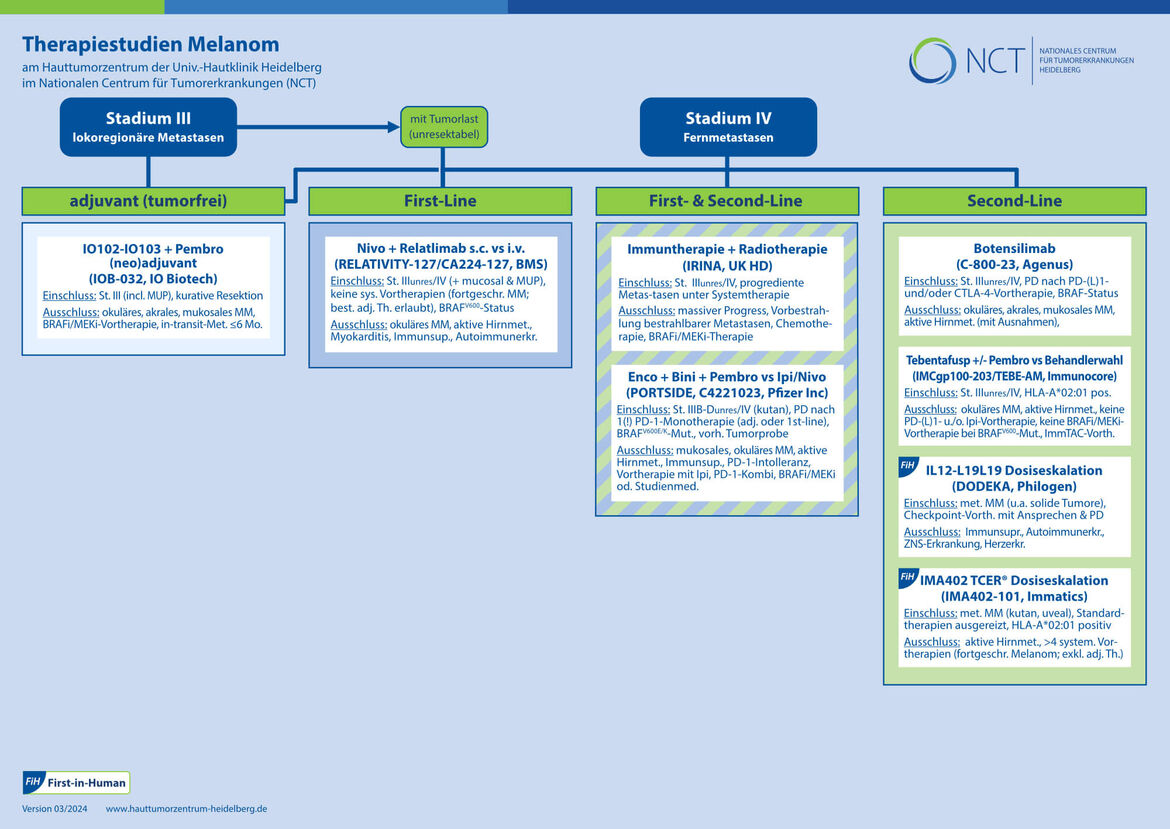
Klinische Studien
Malignes Melanom (Schwarzer Hautkrebs) Stadium I/II
ADJUVANT/TUMORFREI (NACH OP):
| MK-7684A-010/KEYVIBE-010: ADJUVANT MK-7684A (VIBOSTOLIMAB + PEMBROLIZUMAB) VS PEMBROLIZUMAB IM STADIUM IIB-IV (MSD) | |
| Adjuvant MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab Hochrisiko-Melanom im Stadium IIB–IV (MK-7684A-010/KEYVIBE-010). | |
| Einschluss: | kutanes Melanom Stadium IIB-IV, tumorfrei, keine systemische Vortherapie, max. 12 Wochen nach R0-Resektion, vorhandene Tumorprobe |
| Ausschluss: | okuläres, mukosales oder konjunktivales Melanom, Antikrebs-Immunvortherapie (anti-PD-(L)1/2- oder anti-TIGIT, u.a.), Immundefizienz, Immunsuppression, Autoimmunerkr., aktive HBV/HCV |
| Protokoll: | Eine randomisierte, doppelblinde, mit Standardbehandlung-kontrollierte klinische Phase-III-Studie mit adjuvantem MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab bei Teilnehmern mit Hochrisiko-Melanom im Stadium II–IV (KEYVIBE-010). |
| Status: | ❌ Rekrutierung geschlossen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
Malignes Melanom (Schwarzer Hautkrebs) Stadium III
NEOADJUVANT (VOR OP):
| IOB-032 / IO102‑IO103‑032: PEMBROLIZUMAB +/- IO102-IO103 NEOADJUVANT UND ADJUVANT (IO Biotech) | |
| IO102-IO103 in Kombination mit Pembrolizumab adjuvant und nach OP (IOB-032 / PN-E40) | |
| Einschluß: | Kutanes resektables Stadium III Melanom (MUP erlaubt), Resektion mit kurativem Ansatz, vorhandene Tumorprobe |
| Ausschluss: | Uveales, akrales oder mukosales Melanom, Stadium IV, in-transit-Met. in letzten 6 Monaten, BRAF/MEK-Vortherapien, Nebenwirkung Grad ≥3 bei Immuncheckpoint-Vortherapie, Immunsuppression, Autoimmunerkr., akute Lungenerkr., aktiver HIV/HBV/HCV |
| Protokoll: | Phase-II-Studie mit neoadjuvantem und adjuvantem IO102-IO103 und Pembrolizumab bei Patienten mit resezierbaren Tumoren. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu: - | |
ADJUVANT/TUMORFREI (NACH OP):
| MK-7684A-010/KEYVIBE-010: ADJUVANT MK-7684A (VIBOSTOLIMAB + PEMBROLIZUMAB) VS PEMBROLIZUMAB IM STADIUM IIB-IV (MSD) | |
| Adjuvant MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab Hochrisiko-Melanom im Stadium IIB–IV (MK-7684A-010/KEYVIBE-010). | |
| Einschluss: | kutanes Melanom Stadium IIB-IV, tumorfrei, keine systemische Vortherapie, max. 12 Wochen nach R0-Resektion, vorhandene Tumorprobe |
| Ausschluss: | okuläres, mukosales oder konjunktivales Melanom, Antikrebs-Immunvortherapie (anti-PD-(L)1/2- oder anti-TIGIT, u.a.), Immundefizienz, Immunsuppression, Autoimmunerkr., aktive HBV/HCV |
| Protokoll: | Eine randomisierte, doppelblinde, mit Standardbehandlung-kontrollierte klinische Phase-III-Studie mit adjuvantem MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab bei Teilnehmern mit Hochrisiko-Melanom im Stadium II–IV (KEYVIBE-010). |
| Status: | ❌ Rekrutierung geschlossen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
| IOB-032 / IO102‑IO103‑032: PEMBROLIZUMAB +/- IO102-IO103 NEOADJUVANT UND ADJUVANT (IO Biotech) | |
| IO102-IO103 in Kombination mit Pembrolizumab adjuvant und nach OP (IOB-032 / PN-E40) | |
| Einschluß: | Kutanes resektables Stadium III Melanom (MUP erlaubt), Resektion mit kurativem Ansatz, vorhandene Tumorprobe |
| Ausschluss: | Uveales, akrales oder mukosales Melanom, Stadium IV, in-transit-Met. in letzten 6 Monaten, BRAF/MEK-Vortherapien, Nebenwirkung Grad ≥3 bei Immuncheckpoint-Vortherapie, Immunsuppression, Autoimmunerkr., akute Lungenerkr., aktiver HIV/HBV/HCV |
| Protokoll: | Phase-II-Studie mit neoadjuvantem und adjuvantem IO102-IO103 und Pembrolizumab bei Patienten mit resezierbaren Tumoren. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu: - | |
Malignes Melanom Stadium III (unresektabel) und Stadium IV
First-Line-Therapie (erste Therapie):
| MK-7684A-010/KEYVIBE-010: ADJUVANT MK-7684A (VIBOSTOLIMAB + PEMBROLIZUMAB) VS PEMBROLIZUMAB IM STADIUM IIB-IV (MSD) | |
| Adjuvant MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab Hochrisiko-Melanom im Stadium IIB–IV (MK-7684A-010/KEYVIBE-010). | |
| Einschluss: | kutanes Melanom Stadium IIB-IV, tumorfrei, keine systemische Vortherapie, max. 12 Wochen nach R0-Resektion, vorhandene Tumorprobe |
| Ausschluss: | okuläres, mukosales oder konjunktivales Melanom, Antikrebs-Immunvortherapie (anti-PD-(L)1/2- oder anti-TIGIT, u.a.), Immundefizienz, Immunsuppression, Autoimmunerkr., aktive HBV/HCV |
| Protokoll: | Eine randomisierte, doppelblinde, mit Standardbehandlung-kontrollierte klinische Phase-III-Studie mit adjuvantem MK-7684A (Vibostolimab mit Pembrolizumab) versus adjuvantem Pembrolizumab bei Teilnehmern mit Hochrisiko-Melanom im Stadium II–IV (KEYVIBE-010). |
| Status: | ❌ Rekrutierung geschlossen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
| IOB-013: PEMBROLIZUMAB +/- IO102-IO103 (IO Biotech) | |
| IO102-IO103 in Kombination mit Pembrolizumab vs Pembrolizumab alleine bei fortgeschrittenem Melanom (IOB-013 / KN-D18) | |
| Einschluß: | Kutanes, nicht-resektables Stadium III oder Stadium IV Melanom, keine syst. Vortherapie bei fortgeschr. Melanom (bestimmte adj. Vortherapien erlaubt) messbare Tumorläsion, vorhandene Tumorprobe |
| Ausschluss: | Okuläres, akrales oder mukosales Melanom, aktive Hirnmetastasen, BRAFV600-positiv mit raschem Progress, Immunsuppression, Autoimmunerkr., HIV/HBV/HCV |
| Protokoll: | Offene, multi-zentrische, randomisierte Phase-III-Studie mit IO102-IO103 in Kombination mit Pembrolizumab versus Pembrolizumab alleine bei Patienten mit zuvor unbehandeltem, unresektablem oder metastasiertem (fortgeschrittenem) Melanom (IO102-IO103-013 / MK3475-D18). |
| Status: | ❌ Rekrutierung geschlossen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
RELATIVITY-127/CA224-127: NIVOLUMAB + RELATLIMAB subkutan vs intravenös (BMS) | |
Nivolumab + Relatlimab subkutan versus intravenös bei unbehandeltem metastasiertem oder unresektablem Melanom (RELATIVITY-127) | |
| Einschluß: | nicht-resektables Stadium III oder Stadium IV Melanom (inkl. mukosal und unbek. Primarius), keine syst. Vortherapie bei fortgeschr. Melanom (bestimmte adj. Vortherapien erlaubt), messbare Tumorläsion, bekannter BRAF V600-Status, vorhandene Tumorprobe |
| Ausschluss: | Okuläres Melanom, aktive Hirnmetastasen, Autoimmunerkr., aktuelle oder zurückliegende Myokarditis, Immunsuppression, HIV/HBV/HCV |
| Protokoll: | Randomisierte, offene Phase-3-Studie mit subkutaner Fixkombination Nivolumab + Relatlimab versus intravenöser Fixkombination Nivolumab + Relatlimab bei Patienten mit zuvor unbehandeltem metastasiertem oder unresektablem Melanom. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
First-Line- oder Second-Line-Therapie (Folgetherapie):
C4221023, PORTSIDE: ENCORAFENIB + BINIMETINIB + PEMBROLIZUMAB vs NIVOLUMAB + IPILIMUMAB (Pfizer Inc.) | |
Encorafenib und Binimetinib plus Pembrolizumab vs Nivolumab und Ipilimumab bei Patienten mit metastasiertem Melanommit, BRAF-Mutation und Progress nach einer anti-PD-1-Therapie | |
| Einschluß: | kutanes Melanom, nicht-resektables Stadium IIIB-D oder Stadium IV, messbare Tumorläsion, BRAF V600E- oder V600K-Mutation, vorhandene Tumorprobe, (nur) eine syst. anti-PD-1-Vortherapie (adjuvant oder 1st-Line), PD während oder nach anti-PD-1-Therapie, messbare Tumorläsion |
| Ausschluss: | mukosales oder okuläres Melanom, aktive Hirnmetastasen oder leptomeningeale Metastasen, Immunsuppression, Autoimmunerkrankung, Herzerkrankung, anti-PD-1-Intoleranz, Vortherapie mit Ipilimumab, anti-PD-(L)1-Kombi, BRAFi/MEKi, Melanom-Studienwirkstoff, vorherige Teilnahme C4221016/STARBOARD-Studie |
| Protokoll: | Eine randomisierte, offene Phase-II-studie zu Encorafenib und Binimetinib plus Pembrolizumab im Vergleich zu Nivolumab und Ipilimumab bei Teilnehmern mit BRAF-V600e/k-mutationpositivem Melanom mit Krankheitsprogression während oder nach einer vorangegangenen Behandlung mit einer anti-PD-1-Therapie. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
IRINA: IMMUNTHERAPIE + RADIOTHERAPIE (IIT, UK HEIDELBERG) | |
Einfluss einer Bestrahlung auf die Immunantwort nach Immune Checkpoint Blockade in Patienten mit metastasiertem Melanom | |
| Einschluß: | nicht-resektables Stadium III oder Stadium IV, progrediente Metastasen unter Immuntherapie |
| Ausschluss: | massiver Progress, Vorbestrahlung bestrahlbarer Metastasen, Chemotherapie, BRAF/MEK-Therapie |
| Protokoll: | Multizentrische, offene, randomisierte Phase-II-Studie zum Einfluss einer Bestrahlung auf die Immunantwort nach Immune Checkpoint Blockade in Patienten mit metastasiertem Melanom. |
| Status: | ✔️ Rekrutierung offen |
| Details: --- | |
Second-Line-Therapie (Folgetherapie):
C-800-23: BOTENSILIMAB (AGEN1181) (AGENUS INC) | |
Botensilimab (AGEN1181) bei fortgeschrittenem Melanom, therapieresistent bei Checkpoint-Inhibitor-Vortherapie. | |
| Einschluss: | kutanes, unresektables Stadium III oder metastasiertes Stadium IV Melanom, Progress nach anti-PD-(L)1- und/oder anti-CTLA-4-Vortherapie (abh. von Kohorte), BRAF-Status, aktuelle Tumorprobe (Formalin-Block oder nativ) |
| Ausschluss: | Okuläres, uveales oder mukosales Melanom, aktive Hirnmetastasen (Ausnahmen s. Protokoll), Herzerkrankungen, Immunnebenwirkung CTCAE Grad ≥ 3 von Vortherapie, Immunsupression, Autoimmunerkrankung, HIV/HBV/HCV |
| Protokoll: | Eine offene Phase II Kohortenstudie mit Botensilimab (AGEN1181) zur Behandlung von fortgeschrittenen, Checkpoint-Inhibitor-therapieresitente Melanomen. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | |
| IMCgp100-203/TEBE-AM: TEBENTAFUSP +/- PEMBROLIZUMAB VS THERAPIEWAHL DER BEHANDELNDEN (IMMUNOCORE) | |
| Tebentafusp ohne oder mit Pembrolizumab versus Therapiewahl der Behandelnden bei vorbehandeltem fortgeschrittenem Melanom. | |
| Einschluss: | Melanom Stadium IV oder unresektables Stadium III, HLA-A*02:01 positiv, vorhandene Tumorprobe, messbare Tumorläsion |
| Ausschluss: | okuläres/uveales Melanom, aktive Hirnmetastasen/leptomeningeale Met., ernste Nebenwirkungen in PD-(L)1-Vortherapie, ImmTAC-Vortherapie, Lungenerkr., Herzerkr., Immunsuppression, keine PD-(L)1-Mono- oder Kombi-Vortherapie, keine Ipilimumab-Vortherapie, keine BRAFi/MEKi-Vortherapie bei BRAF V600-Mutation |
| Protokoll: | Randomisiserte Phase II/III-Studie mit Tebentafusp als Monotherapie und in Kombination mit Pembrolizumab versus Therapiewahl der Behandelnden bei HLA-A*02:01-positiven Patienten mit vorbehandeltem fortgeschrittenem Melanom (TEBE-AM). |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu: - | |
Phase I-Studien/First-in-Human (Erstanwendung im Menschen):
DODEKA (PH-IL12L19L19-01/19): IL12-L19L19 DOSISESKALATION (Philogen S.p.a.) | |
Dosiseskalation von IL12-L19L19 bei fortgeschrittenen soliden Tumoren und DLBCL nach vorheriger Immuncheckpointtherapie | |
| Einschluss: | metastasiertes Melanom (u.a. solide Tumore, DLBCL), Immuncheckpoint-Vortherapie mit Ansprechen und Progress, ≥1 messbare Läsion |
| Ausschluss: | Autoimmunerkr., ZNS-Erkrankung, Herzerkrankungen, Immunsupression |
| Protokoll: | Eine Phase I Studie zur Beurteilung der Sicherheit und frühen Anzeichen der Wirksamkeit des humanen monoklonalen Antikörper-Zytokin Fusionsproteins IL12-L19L19. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | |
IMA402-101: IMA402 TCER® DOSISESKALATION (IMMATICS) | |
IMA402 TCER® bei rezidivierenden und/oder refraktären soliden Tumoren | |
| Einschluss: | fortgeschr. und/oder metastasiertes Melanom (kutan, uveal), HLA-A*02:01 positiv, alle Standardtherapien ausgereizt, ≥1 messbare Läsion |
| Ausschluss: | Aktive Hirnmetastasen, Immunsupression, Autoimmunerkr., Herzerkrankungen, HIV/HBV/HCV, >4 systemische Vortherapien bei fortgeschr. Melanom (exkl. adj. Therapien) |
| Protokoll: | Eine klinische First-in-human Phase I/II-Studie zur Bewertung der Sicherheit, Verträglichkeit und Anti-Tumoraktivität von IMA402, einem bispezifischen T Cell-Enganging Receptor-Molekül (TCER®) gegen PRAME, in Patienten mit rezidivierenden und/oder refraktären soliden Tumoren. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | |
IMC-F106C-101: IMC-F106C +/- CHECKPOINT-INHIBITOR (IMMUNOCORE) | |
Phase 1/2-Studie mit IMC-F106C bei fortgeschrittenen PRAME-positiven Krebserkrankungen. | |
| Einschluss: | metastasierte oder unresektable PRAME-positive Tumore (hier: Melanom kutan/mukosal/uveal), HLA-A*02:01 positiv, erforderliche/erlaubte Vortherapien abhängig von Studienarm |
| Ausschluss: | Aktive Hirnmetastasen/leptomeningeale Met., bestimmte Nebenwirkungen aus Vortherapien (abh. von Studienarm), Lungen-/Herzerkrankung, Autoimmunsupression, HIV/HBV/HCV, Vortherapie mit Tebentafusp, IMCnyeso oder IMC-C103C |
| Protokoll: | Eine First-in-human Phase I/II-Studie zur Bewertung der Sicherheit und Wirksamkeit von IMC-F106C als Einzelpräparat und in Kombination mit Checkpoint-Inhibitoren bei HLA-A*02:01-positiven Patienten mit fortgeschrittener PRAME-positiver Krebserkrankung. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
Plattenepithelkarzinom (Spinaliom, SCC, weißer Hautkrebs)
R2810-ONC-1788: ADJUVANT CEMIPLIMAB VS PLACEBO (REGENERON) | |
| Adjuvant Cemiplimab vs Placebo nach Operation und Strahlentherapie bei kutanen Hochrisiko-Plattenepithelkarzinomen (cSCC). | |
| Einschluss: | vollst. reseziertes, kutanes Hochrisiko-cSCC, abgeschl. post-operative Strahlentherapie |
| Ausschluss: | systemische Vortherapie für cSCC, weitere Tumorerkrankung, hämatologisches Malignom, Fernmetastasen vor weniger als 3 Jahren, Autoimmunerkrankung |
| Protokoll: | Randomisierte, Placebo-kontrollierte, doppel-blinde Studie mit adjuvantem Cemiplimab versus Placebo nach Operation und Strahlentherapie bei Patienten mit REGN2810, einem humanen, monoklonalen PD-1-Antikörper, bei Patienten mit kutanem Hochrisiko-Plattenepithelkarzinom. |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
DUNCAN (PH-L19IL2TNFNMSC-04/19): L19IL2/L19TNF INTRATUMORAL (Philogen S.p.A.) | |
Intratumorale Injektion von L19IL2/L19TNF bei weißem Hautkrebs mit injizierbaren Läsionen. | |
| Einschluß: | lokal fortgeschrittene Hochrisiko-Basalzell- und -Plattenepithelkarzinome, intratumorale Injektion mögllich, OP ausgeschlossen |
| Ausschluss: | Andere Krebserkrankung vor ≤ 2 Jahren, Kandidat für Hedgehog- oder Checkpoint-Inhibitor, aktive Infektion, Autoimmunerkr., Immunsuppression |
| Protokoll: | Eine klinische Phase II Studie zur Untersuchung der intratumoralen Injektion von L19IL2/L19TNF in nicht-Melanoma Hautkrebs in Patienten mit injizierbaren Läsionen |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
Basalzellkarzinom (Basaliom, BCC, weißer Hautkrebs)
DUNCAN (PH-L19IL2TNFNMSC-04/19): L19IL2/L19TNF INTRATUMORAL (Philogen S.p.A.) | |
Intratumorale Injektion von 19IL2/L19TNF bei weißem Hautkrebs mit injizierbaren Läsionen. | |
| Einschluß: | lokal fortgeschrittene Hochrisiko-Basalzell- und -Plattenepithelkarzinome, intratumorale Injektion mögllich, OP ausgeschlossen |
| Ausschluss: | Andere Krebserkrankung vor ≤ 2 Jahren, Kandidat für Hedgehog- oder Checkpoint-Inhibitor, aktive Infektion, Autoimmunerkr., Immunsuppression |
| Protokoll: | Eine klinische Phase II Studie zur Untersuchung der intratumoralen Injektion von L19IL2/L19TNF in nicht-Melanoma Hautkrebs in Patienten mit injizierbaren Läsionen |
| Status: | ✔️ Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |