Projekte
Makrophagendifferenzierung und -heterogenität in der Atheroskleros
Atherosklerotische Läsionen entstehen, wenn Monozyten sich an das Gefässendothel anlagern, in die Gefäßwand einwandern und dort zu Makrophagen differenzieren. Unter dem Einfluss lokaler Faktoren, insbesondere von im subendothelialen Raum befindlichen oxidierten LDL, entwickeln sich diese Makrophagen zu sogenannten Schaumzellen. Diese tragen durch Expression proinflammatorischer Zytokine, Matrix-Metalloproteinasen sowie anderer Mediatoren zur Aufrechterhaltung eines Entzündungsprozesses bei. Durch apoptotischen Zelltod gehen die Schaumzellen schließlich zugrunde und bilden den sogenannten nekrotischen Kern der atherosklerotischen Plaques.
In den letzten Jahren ist deutlich geworden, dass es sich bei Makrophagen im allgemeinen und Plaquemakrophagen im Besonderen nicht um einen einheitlichen Zelltyp handelt. So konnte gezeigt werden, dass durch verschiedene Zytokine unterschiedliche Muster von Oberflächenrezeptoren und Enyzmen in Makrophagen induziert werden. Analog zu T-Zellen konnte die Existenz von unterschiedlichen Makrophagensubtypen in vitro und in vivo demonstriert werden. Während M1-Makrophagen (u.a. induziert durch Interferon-gamma und LPS) eher pro-inflammatorisch wirken, haben M2-Makrophagen (u.a. induziert durch IL-4) eher anti-inflammatorische Effekte. Unser Labor konnte mit den durch CXCL4 induzierten M4-Makrophagen einen weiteren Makrophagentypen identifizieren und charakterisieren, der möglicherweise eine wichtige Rolle im Rahmen der Atherosklerose spielt.
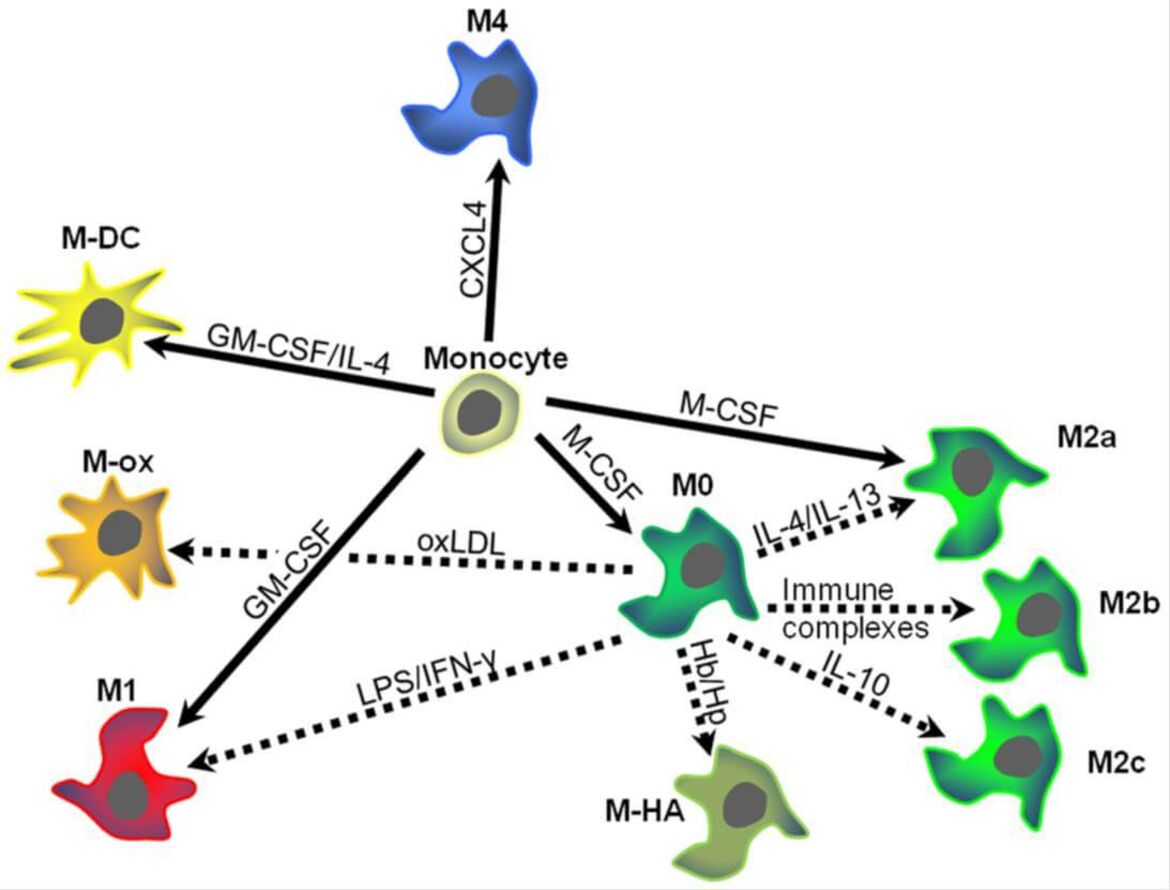
Ziel unseres Labors ist es, die Differenzierung von Plaquemakrophagen und Ihre Bedeutung für die Läsionsentwicklung besser zu verstehen. Welche Faktoren beeinflussen die Differenzierung und Polarisierung von Makrophagen? Wieviel Plastizität besteht zwischen verschiedenen Polarisierungstypen? Welche Rolle spielen diese unterschiedlichen Differenzierungstypen für die Entstehung und den Verlauf der Atherosklerose? Welche Interaktionen ergeben sich mit anderen Zelltypen wie beispielsweise T-Lymphozyten? Welche diagnostischen und therapeutischen Ansätze ergeben sich aus den gewonnenen Erkenntnissen?
Folgende Schwerpunkte werden derzeit bearbeitet:
- Effekte unterschiedliche Wachstumsfaktoren, Zytokine und Chemokine auf die Makrophagendifferenzierung
- Identifikation von Modulatoren der Makrophagen- und Schaumzelldifferenzierung
- Identifikation und Validierung potentieller Biomarker zur Risikostratifizierung der koronaren Herzerkrankung
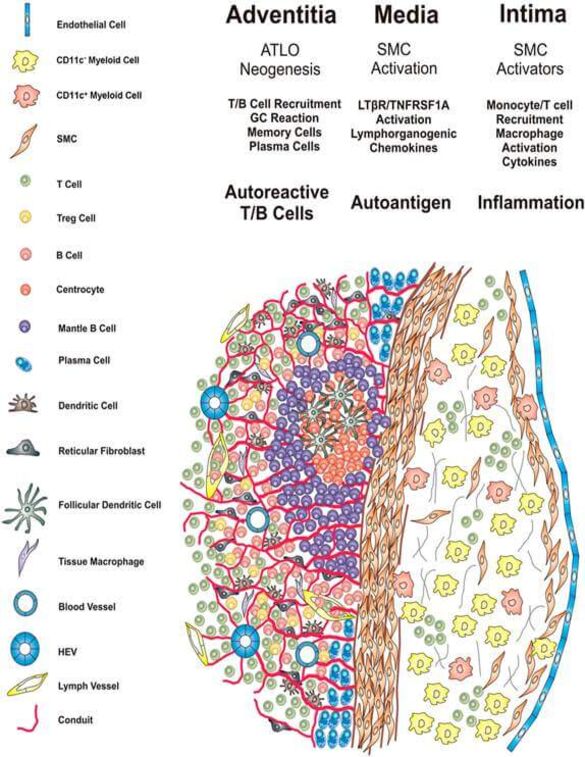
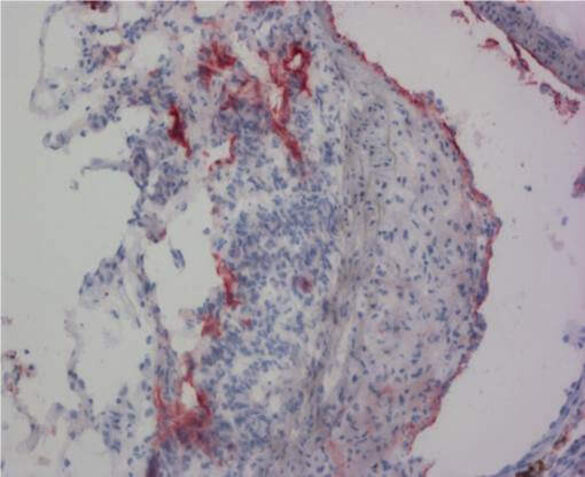
Tertiäre lymphoide Strukturen in der Adventitia von benachbarten atherosklerotischen Läsionen
Die atherosklerotische Läsion stellt eine der Haupttodesursachen in den Industrienationen dar. Die Pathogenese der Atherosklerose ist ein chronisch entzündlicher Prozess, an dem immunkompetente Zellen wie die T-Zellen, Makrophagen und Dendritische Zellen beteiligt sind. Seit langem ist bekannt, dass sich inflammatorische Zellen nicht nur in der Lamina intima, sondern auch in der Lamina adventitia von arteriellen Gefäße befinden. Zudem konnte gezeigt werden, dass Patienten mit einer instabilen Angina pectoris Symptomatik signifikant mehr zelluläre Ansammlungen in der Adventitia aufweisen als Patienten mit einer stabilen koronaren Herzerkrankung. In den letzten Jahren zeigte sich, dass sich diese Zellansammlungen im Apoe-/- Mausmodell zu TLOs entwickeln können. Tertiäre lymphoide Strukturen (TLO) sind definiert als Ansammlung von lymphoiden Zellen in Verbindung mit einer chronisch inflammatorischen Erkrankung, die sich im Aufbau und der zellulären Struktur den sekundären Lymphorganen mit der Bildung von Keimzentren (germinal centre) ähneln. TLOs sind bei verschiedenen chronisch inflammatorischen (autoimmunen) Erkrankungen wie der Rheumatoiden Arthritis, dem Sjörgen-Syndrom, dem Diabetes mellitus und der Autoimmunthyreoditis nachzuweisen. Ziel der jetzigen Studie ist es die Entstehung und Entwicklung der tertiären lymphoiden Strukturen sowie deren Interaktion mit den atherosklerotischen Läsionen in den Aortensinusoiden in dem Apoe-/- Mausmodell zu untersuchen. Zu verschiedenen Zeitpunkten wird der Aortensinus entnommen und die Entwicklung der tertiären lymphoiden Strukturen in der Adventitia untersucht.
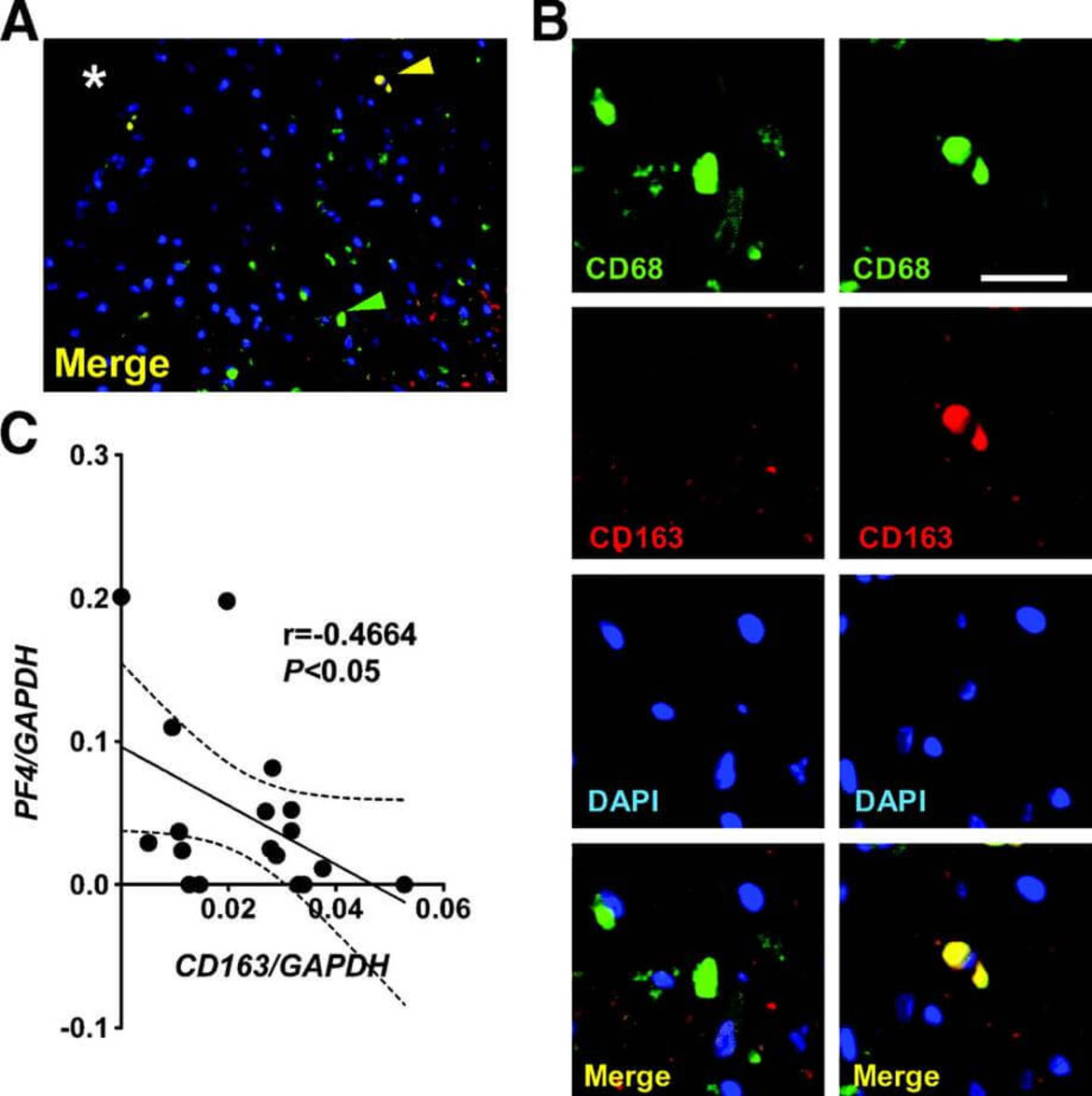
Rolle von T Zellen und verschiedenen Zytokinen in atherosklerotischen Läsionen
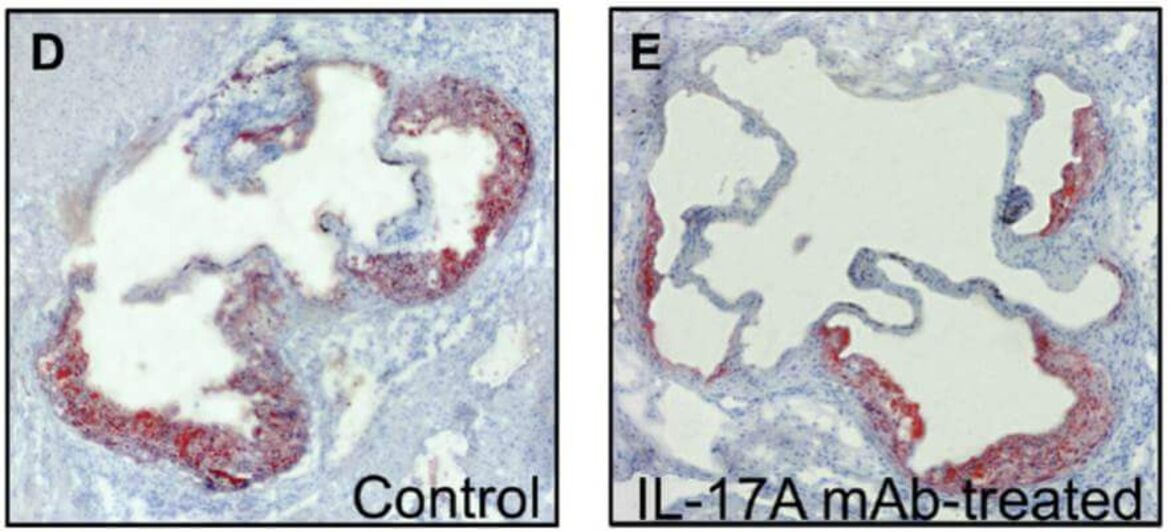
Die Entwicklung der Atherosklerose ist ein chronisch inflammatorischer, möglicherweise autoimmuner Prozess. Sowohl Makrophagen, dendritische Zellen als auch T-Zellen scheinen hier eine entscheidende Rolle zu spielen. Wir sind insbesondere daran interessiert, wie T-Zellen mit Antigen-präsentierenden Zellen interagieren, welche Rolle bestimmte Zytokine, pharmakologischer Substanzen und andere Mediatoren auf die Aktivierung und Costimulation von T-Zellen haben. Weiterhin versuchen wir die Diversität verschiedener T-Zell-Subtypen besser zu verstehen, hierbei liegt ein besonderer Schwerpunkt auf der Interleukin-17-produzierenden Th17 Zelle. Folgende Schwerpunkte werden derzeit bearbeitet:
Projekte zur Modulation der T-Zellantwort, v.a. IL-17 und TNFSF14, im Rahmen der Atherogenese.
Klinische Projekte
Der langfristige Erfolg von Herztransplantationen wird heute überwiegend durch stenosierende Gefäßveränderungen beeinträchtigt, die durch einen chronischen Immunprozess bedingt sind und als Transplantatvaskulopathie (TVP) bezeichnet werden. Als initiales Ereignis in der Pathogenese wird die Schädigung des Gefäßendothels im Transplantat angesehen, die anschließend eine Kaskade entzündlicher Prozesse auslöst. Die exakten Pathomechanismen der TVP sind bislang nicht bekannt.
Transplantationsimmunologie
Immunologische Prozesse zu verstehen und als therapeutische Ansätze für zukünftige Immunsuppressiva zu verwenden ist für die transplantierten Patienten unerlässlich. Bereits durchgeführte Studien haben den Einfluss des Zytomegalievirus, verantwortlich für die häufigste Virusinfektion nach der Transplantation, auf das Endothel untersucht. In einem neu aufgelegten Forschungsprojekt wird nun neben der bereits bestehenden klinischen Datenbank eine weitere zellbiologische/immunologische Datenbank aufgebaut, um klinische Befunde mit zellulären/immunologischen Gegebenheiten verbinden zu können.
Regelmäßig lassen sich mittels der dafür angelegten Datenbank verschiedenste Fragestellung weitergehend analysieren mit dem Ziel, die Therapie für die transplantierten Patienten weiter optimieren zu können, hier am Beispiel zu dem Medikament Ivabradin: In einer Heidelberger Pilotstudie wurden 25 Patienten untersucht. Die durch die Herztransplantation verursachte Spenderherzdenervation führt zur Sinustachykardie. Der If-Kanal-Antagonist Ivabradin reduzierte selektiv die Herzfrequenz nach Herztransplantation, die potentiell sogar besser tolerabel war als in der Vergleichsgruppe, die eine Beta-Blocker-Therapie erhielten. Zudem werden Herzmuskelbiopsien sowie Serumproben zur Evaluierung von möglichen neuen Biomarkern in Bezug auf die akute Abstossung, die Prognose und die Transplantatvaskulopathie untersucht.
Plasmapharese bei dilatativer Kardiomyopathie
Die dilatative Kardiomyopathie (DCM) ist eine progressive Erkrankung mit einer fortschreitenden Verschlechterung der kontraktilen Funktion bei gleichzeitiger Dilatation des linken Ventrikels. Diese Erkrankung stellt neben der koronaren Herzkrankheit die häufigste Ursache der terminalen Herzinsuffizienz dar. Neuen Befunden zufolge spielen inflammatorische Prozesse mit Aktivierung des humoralen Immunsystems eine entscheidende Rolle. Antikörper gegen verschiedene kardiale Strukturen wurden bei den DCM-Patienten nachgewiesen. Die Entfernung der kardialen Autoantikörper aus dem Patientenplasma durch eine Plasmapharese kann zu einer Verbesserung der Herzfunktion wie auch eine Rückbildung der Myokardinflammation führen.