Basic HTML-Version


37
Zwei Gehirnareale, die als zentra-
le Schaltstellen für die räumliche
Orientierung und das Ortsge-
dächtnis gelten, sind durch lange
Ausläufer hemmender Nervenzel-
len direkt miteinander verbun-
den. Das haben Wissenschaftler
um Professor Hannah Monyer, Leiterin einer Kooperationsabtei-
lung des Deutschen Krebsforschungszentrums, der Universität
und des Klinikums, entdeckt und in der Zeitschrift „Science“ ver-
öffentlicht.
Die Direktverbindung zwischen den Hirnregionen Hippocampus
und Entorhinaler Cortex trägt vermutlich dazu bei, die beiden Are-
ale zu synchronisieren und räumliche Eindrücke zu verarbeiten.
„Bisher kannte man nur erregende Nervenfasern zwischen den
beiden Arealen“, erläutert Monyer. „Wir konnten nun zeigen, dass
darüber hinaus auch hemmende Neurone Direktverbindungen
zwischen den beiden Strukturen ausbilden.“
Neues Nachweisverfahren macht
Nervenzellen sichtbar
Die Forscher setzten ein neues Nachweisverfahren ein, um die
Nervenzellen sichtbar zu machen und ihre Funktion zu prüfen: Sie
schleusten ein leuchtendes lichtempfindliches Protein in die hem-
menden Langstreckenneuronen im Gehirn von Mäusen ein. So
konnten sie unter dem Mikroskop den Verlauf der Nervenausläu-
fer verfolgen und diese mittels Laserpulsen aktivieren. „Mit jedem
Nervenschaltkreis, den wir neu entdecken und verstehen, gewin-
nen wir ein besseres Gesamtbild davon, wie verschiedene Areale
unseres Gehirns orchestriert sind. Dieses koordinierte Zusam-
menwirken verschiedener Strukturen ist die physiologische
Grundlage für Lernen und Gedächtnis“, erläutert Monyer.
TB
36
FORSCHUNG
Ein körpereigenes Eiweiß schädigt bei
chronischer Herzschwäche, z.B. nach
einem Herzinfarkt, das angegriffene Herz
zusätzlich: Es verringert die Fähigkeit der
Herzmuskelzellen, sich zusammenzuzie-
hen, das Herz verliert an Pumpkraft. Die
molekularen Zusammenhänge haben
Wissenschaftler des Klinikums um Dr.
Philip Raake erforscht und in der renom-
mierten Fachzeitschrift „Circulation“ ver-
öffentlicht.
Das schwächende Protein GRK2, das im
Herzen von Patienten mit Herzinsuffizienz
in mehr als doppelt so hoher Konzentrati-
on wie bei Gesunden vorkommt, ist ein
vielversprechender Angriffspunkt für
neue Therapien. Diese könnten z.B. die
gängigen Behandlungskonzepte sinnvoll
ergänzen. Rund drei Millionen Menschen
in Deutschland leiden an chronischer
Herzinsuffizienz, bis zu 30 Prozent von ih-
nen sterben jährlich daran. Bei ungefähr
zwei Dritteln der Betroffenen ist ein Herzin-
farkt der Auslöser für die unheilbare Er-
krankung.
Ziel: Die molekulare Ketten-
reaktion unterbrechen
Der Anteil an zerstörtem Gewebe allein er-
klärt allerdings nicht den zunehmenden
Funktionsverlust des Herzens. „Das Herz
kompensiert den Schaden durch Mehrar-
beit. Dabei werden molekulare Kettenreak-
tionen angestoßen, die auf Dauer auch die
verbliebenen gesunden Herzzellen schädi-
gen“, sagt Dr. Raake, Leiter des Labors
„Molekulare Zielstrukturen bei Herzerkran-
kungen“ in der Kardiologischen Klinik.
„Wenn wir diese Mechanismen besser ver-
stehen, können wir sie gezielt unterbre-
chen und die Leistungsfähigkeit des Her-
zens erhalten.“
TB
Nach Infarkt:
Körpereigenes Protein
schwächt das Herz zusätzlich
Direktverbindung im Gehirn
für räumliche Orientierung
Das körpereigene Eiweiß verringert die
Fähigkeit der Herzmuskelzellen, sich
zusammenzuziehen, das Herz verliert
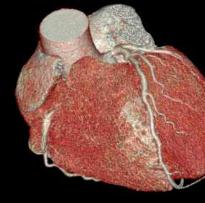
an Pumpkraft. Das Bild zeigt ein gesun-
des Herz in einer MRT-Aufnahme.
Wie erfolgreich ist die interdiszipli-
näre Behandlung von Brustkrebs?
Das Brustzentrum am Klinikum hat
seit 2003 bei mehr als 3.300 Pati-
entinnen den Verlauf der Erkran-
kung systematisch begleitet und
als erstes Zentrum in Deutschland
diese aussagekräftigen prospektiven Ergebnisse veröffentlicht.
86 Prozent überleben die ersten fünf Jahre
86 Prozent überlebten die ersten fünf Jahre nach Therapiebeginn;
bei 80 Prozent kehrte der Krebs in dieser Zeit auch nicht zurück.
Die Auswertung wurde online in der Fachzeitschrift „The Breast“
veröffentlicht.
„Die Prognose von Brustkrebs hat sich aufgrund neuer Therapie-
optionen und der konsequenten interdisziplinären Behandlung
weiter verbessert“, sagt Professor Dr. Christof Sohn, Ärztlicher Di-
rektor der Frauenklinik und Leiter des Brustzentrums. Die Heidel-
berger Ergebnisse belegen dies: Eine Auswertung deutscher
Krebsregister durch das Robert Koch Institut im Jahr 2010 ergab für
die Zeitspanne von 2000 bis 2004 für Brustkrebspatientinnen
eine Wahrscheinlichkeit von 79,6 Prozent, die ersten fünf Jahre
nach Therapie zu überleben. Eine aktuelle Arbeit des Deutschen
Krebsforschungszentrums, in der Daten elf deutscher Krebsregi-
ster aus den Jahren 2002 bis 2006 analysiert wurden, kommt auf
rund 84 Prozent. In den USA lag diese Wahrscheinlichkeit laut US-
amerikanischem National Cancer Institute zwischen 1999 und
2006 bei 89 Prozent.
TB
Die Prognose von Brustkrebs
hat sich verbessert
Zielgerichtete Therapie gegen das fehlerhaft aktivierte BRAF-Pro-
tein wirkt auch bei Haarzell-Leukämie, einer seltenen Blutkrebs-
art. Dies konnten Ärzte und Wissenschaftler der Medizinischen
Klinik, des Nationalen Centrums für Tumorerkrankungen (NCT)
und des Deutschen Krebsforschungszentrums (DKFZ) nachwei-
sen. Die Ergebnisse bilden die Grundlage für die klinische Ent-
wicklung neuer Therapien, die sich spezifisch gegen das in den
Blutzellen veränderte BRAF-Protein richten. Ihren Fallbericht veröf-
fentlichten die Forscher in der neuesten Ausgabe des New Eng-
land Journal of Medicine.
Die Haarzell-Leukämie – ihr Name lässt sich ableiten von dem
charakteristischen Aussehen der Zellausläufer der Krebszellen –
ist eine seltene Blutkrebsart, die mit Knochenmarksinfiltration,
Milzvergrößerung und Blutbildveränderungen einhergeht. Män-
ner sind, aus nicht bekannten Gründen, viermal häufiger betroffen
als Frauen. Bei fast allen Haarzell-Leukämie-Erkrankten liegen Mu-
tationen des BRAF-Gens vor.
Neue Dimension der Krebsbekämpfung
durch Ursachenforschung
Wissenschaftlern um Professor Dr. Thorsten Zenz von der Medizi-
nischen Klinik V (Ärztlicher Direktor: Professor Dr. Anthony D. Ho)
und der Abteilung Translationale Onkologie des DKFZ/NCT (Lei-
tung: Professor Dr. Christof von Kalle) gelang es nun, die Wirksam-
keit eines spezifischen BRAF-Hemmers (Wirkstoff: Vemurafenib)
bei Haarzell-Leukämie nachzuweisen: Sie behandelten erfolgreich
einen Patienten, der an Haarzell-Leukämie litt und zuvor auf eine
Reihe von Chemotherapien nicht angesprochen hatte. Unter nied-
riger Dosierung des Medikaments bildeten sich die Krankheits-
symptome vollständig zurück. „Auch wenn die bisherige Stan-
dard-Chemotherapie für die Mehrzahl der Patienten sehr effektiv
ist, eröffnet der Erfolg dieser gezielten Therapie eine neue Dimen-
sion der Krebsbekämpfung durch Ursachenforschung“ fasst Pro-
fessor Dr. Anthony D. Ho zusammen.
AT
Neuer, zielgerichteter Therapieansatz
bei Haarzell-Leukämie
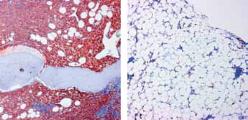
Knochenmark eines Patienten mit Haarzell-Leukämie unter dem
Mikroskop: Vor der Behandlung mit dem BRAF-Inhibitor sind
viele Haarzell-Leukämiezellen (rot) zu sehen (li.). Unter der The-
rapie geht die Besiedelung mit Leukämiezellen zurück.

