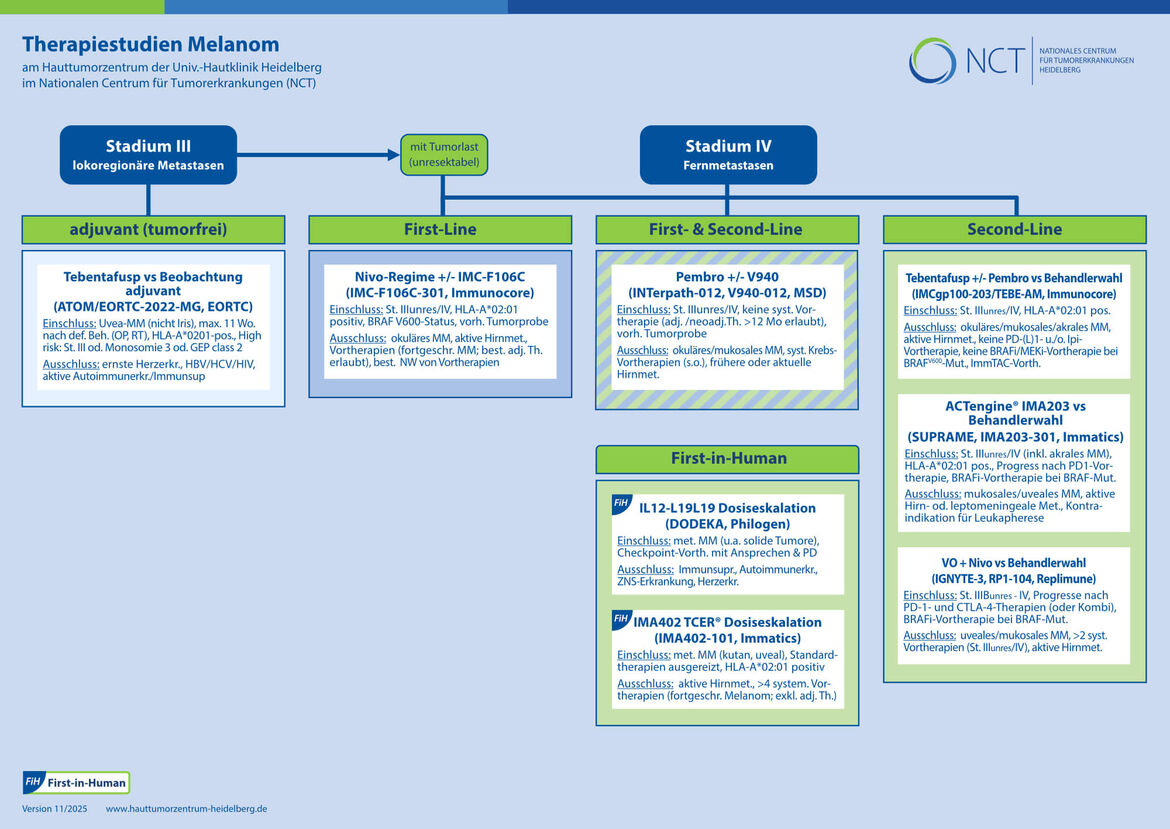
Klinische Studien
Malignes Melanom (Schwarzer Hautkrebs) Stadium III
ADJUVANT/TUMORFREI (NACH OP):
| ATOM / EORTC-2022-MG: adjuvant Tebentafusp vs Beobachtung (EORTC) | |
| Adjuvantes Tebentafusp bei Hochrisiko-Aderhautmelanomen (ATOM) | |
| Einschluß: | nicht metastasiertes Aderhautmelanom (nicht Iris), nach definitiver Behandlung (vor max. 11 Wochen) durch Operation oder Bestrahlung, HLA-A*0201-positiv, Hochrisiko-Uvea-Melanom: Stadium III (AJCC 8) oder Monosomie 3 oder GEP class 2 |
| Ausschluss: | aktive Autoimmunerkrankung/Immunsuppression, ernste Herzerkrankungen, HBV/HCV/HIV |
| Protokoll: | Adjuvante Behandlung mit Tebentafusp (IMCgp100) im Vergleich zur Beobachtung bei HLA-A*0201-positiven Patienten mit nicht-metastasiertem Aderhautmelanom mit hohem Risiko: eine randomisierte Phase-III-Studie der EORTC (ATOM-Studie) |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | euclinicaltrials.eu | |
Malignes Melanom Stadium III (unresektabel) und Stadium IV
First-Line-Therapie (erste Therapie):
| IMC-F106C-301 / PRISM-MEL-301: IMC-F106C + NIVO vs NIVO +/- RELATLIMAB (IMMUNOCORE) | |
| IMC-F106C-Regime im Vergleich zu Nivolumab-Regimen bei zuvor unbehandeltem fortgeschrittenem Melanom (PRISM-MEL-301) | |
| Einschluss: | Stadium IV oder unresektables Stadium III Melanom, HLA-A*02:01 positiv, messbare Tumorläsion, vorhandene Tumorprobe, BRAF V600-Status |
| Ausschluss: | okulares/uveales Melanom, aktive Hirnmetastasen/leptomeningeale Met., Lungenerkr., Herzerkr., Autoimmunerkr., Immunsuppression, HBV/HCV/HIV, syst. Vortherapie bei fortgeschr. Melanom (bestimmte adj. Vortherapien erlaubt), bestimmte Nebenwirkungen bei Vortherapien |
| Protokoll: | Randomisierte, kontrollierte Phase-3-Studie von IMC-F106C plus Nivolumab gegenüber Nivolumab-Regimen bei HLA-A*02:01-positiven Teilnehmern mit zuvor unbehandeltem Melanom (PRISM-MEL-301). |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | |
| IDE196-002: IDE196 (Darovasertib) + Crizotinib vs Behandlerwahl (IDEAYA) | |
| IDE196 (Darovasertib) in Kombination mit Crizotinib als Erstlinientherapie bei metastasiertem Uvea-Melanoma | |
| Einschluß: | metastasiertes Uvea-Melanom, HLA-A*02:01 negativ, keine systemische Vortherapien oder Leber-gerichtete Therapie (kurative, (neo)adjuvante Therapien erlaubt), vorhandene Tumorprobe, messbare Tumorläsion |
| Ausschluss: | Vorbehandlung mit PKC-Inhibitor, MET-Inhibitor oder GNAQ/11-Inhibitor, andere aktive Tumorerkrankung, aktive Hirnmetastasen, aktive HIV/HBV/HCV-Erkr., aktive Nebenniereninsuffizienz oder aktive entzündliche Darmerkrankung, stattgehabte Synkope/Herzerkrankungen (Abklärung) |
| Protokoll: | IDE196 (Darovasertib) in Kombination mit Crizotinib im Vergleich zur Behandlungswahl als Erstlinientherapie bei HLA-A2-negativem metastasiertem Aderhautmelanom (DAR-UM-2) |
| Status: | 🔴 Rekrutierung geschlossen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu | |
First-Line- oder Second-Line-Therapie (Folgetherapie):
| INTerpath-012 (V940-012): V940 + PEMBROLIZUMAB vs PLACEBO + PEMBROLIZUMAB (MSD) | |
| First-line V940 + Pembrolizumab vs Placebo + Pembrolizumab bei fortgeschrittenem Melanom | |
| Einschluß: | Kutanes Stadium IV oder unresektables Stadium III Melanom, keine syst. Melanom-Vortherapie (außer adj./neoadj. Therapie vor >12 Monaten), messbare Tumorläsion, vorhandene Tumorprobe |
| Ausschluss: | Okuläres/mukosales Melanom, syst. Krebs-Vortherapie (vgl. oben), frühere oder aktuelle Hirnmetastasen, aktive HIV/HBV/HCV-Erkr., Immunsup., aktive Autoimmunerkr. |
| Protokoll: | Randomisierte, doppelt-verblindete, Placebo- und Vergleichsmedikament-kontrollierte Phase 2-Studie mit V940 (mRNA-4157) plus Pembrolizumab versus Placebo plus Pembrolizumab als first-line Therapie bei Patienten mit fortgeschrittenem Melanom (INTerpath-012) |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | euclinicaltrials.eu: - | |
Second-Line-Therapie (Folgetherapie):
| IMCgp100-203/TEBE-AM: TEBENTAFUSP +/- PEMBROLIZUMAB VS THERAPIEWAHL DER BEHANDELNDEN (IMMUNOCORE) | |
| Tebentafusp ohne oder mit Pembrolizumab versus Therapiewahl der Behandelnden bei vorbehandeltem fortgeschrittenem Melanom. | |
| Einschluss: | Melanom Stadium IV oder unresektables Stadium III, HLA-A*02:01 positiv, vorhandene Tumorprobe, messbare Tumorläsion |
| Ausschluss: | okuläres/uveales Melanom, mukosales Melanom, akrales Melanom, aktive Hirnmetastasen/leptomeningeale Met., ernste Nebenwirkungen in PD-(L)1-Vortherapie, ImmTAC-Vortherapie, Lungenerkr., Herzerkr., Immunsuppression, keine PD-(L)1-Mono- oder Kombi-Vortherapie, keine Ipilimumab-Vortherapie, keine BRAFi/MEKi-Vortherapie bei BRAF V600-Mutation |
| Protokoll: | Randomisiserte Phase II/III-Studie mit Tebentafusp als Monotherapie und in Kombination mit Pembrolizumab versus Therapiewahl der Behandelnden bei HLA-A*02:01-positiven Patienten mit vorbehandeltem fortgeschrittenem Melanom (TEBE-AM). |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | clinicaltrialsregister.eu: - | |
| SUPRAME (IMA203-301): ACTengine® IMA203 vs BEHANDLERWAHL (IMMATICS) | |
| ACTengine® IMA203 versus Behandlerwahl bei vorbehandeltem, inoperablem oder metastasiertem kutanem Melanom (SUPRAME) | |
| Einschluss: | unresektables oder metastasiertes kutanes Melanom (inkl. akrales MM), HLA-A*02:01 positiv, Progression nach anti-PD1-Therapie (Mono oder Kombi), BRAF-Inhibitor-Vortherapie bei BRAF-Mut., messbare Tumorläsion(en) |
| Ausschluss: | Mucosales/uveales Melanom/MUP, aktive Hirnmetastasen oder leptomeningeale Met., Immunsupression, Autoimmunerkr., Herzerkrankungen, aktives HIV/HBV/HCV, Kontraindikation für Leukapherese |
| Protokoll: | Prospektive, multizentrische, offene, randomisierte, aktiv kontrollierte, parallele Phase-3-Studie zur Untersuchung der Wirksamkeit, Sicherheit und Verträglichkeit von IMA203 versus der Behandlung nach Prüfarztwahl bei Patienten mit vorbehandeltem, inoperablem oder metastasiertem kutanem Melanom (ACTengine® IMA203-301) |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | euclinicaltrials.eu | |
| IGNYTE-3 (RP1-104): VUSOLIMOGENE ODERPAREPVEC + NIVOLUMAB VS BEHANDLERWAHL (REPLIMUNE) | |
| Vusolimogene Oderparepvec (VO) + Nivolumab versus Behandlerwahl bei fortgeschrittenem Melanom nach Progress unter anti-PD-1- und anti-CTLA-4-Therapien (IGNYTE-3) | |
| Einschluss: | unresektables oder metastasiertes kutanes Melanom St. IIIB-IV, Progression nach anti-PD1- und anti-CTLA-4-Therapie (Mono oder Kombi), BRAF-Inhibitor-Vortherapie bei BRAF V600-Mut., messbare Tumorläsion |
| Ausschluss: | mucosales/uveales Melanom, >2 systemische Vortherapien (fortgeschr. MM, Ausnahme: 1x adj. Vortherapie), aktive Hirnmetastasen oder Meningeosis carc., aktives HBV/HCV/HIV/HSV-1, signif. Herzerkrankungen, Autoimmunerkr., onkolytische Vortherapie, Immunsupression |
| Protokoll: | Randomisierte, kontrollierte, multizentrische Phase-III Studie zum Vergleich von Vusolimogene Oderparepvec in Kombination mit Nivolumab versus Behandlung nach Prüfarztwahl bei Patienten mit fortgeschrittenem Melanom, dass sich unter anti-PD-1- und anti-CTLA-4-Behandlung progredient zeigte (IGNYTE-3). |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | euclinicaltrials.eu | |
Phase I-Studien/First-in-Human (Erstanwendung im Menschen):
| DODEKA (PH-IL12L19L19-01/19): IL12-L19L19 DOSISESKALATION (Philogen S.p.a.) | |
| Dosiseskalation von IL12-L19L19 bei fortgeschrittenen soliden Tumoren und DLBCL nach vorheriger Immuncheckpointtherapie | |
| Einschluss: | metastasiertes Melanom (u.a. solide Tumore, DLBCL), Immuncheckpoint-Vortherapie mit Ansprechen und Progress, ≥1 messbare Läsion |
| Ausschluss: | Autoimmunerkr., ZNS-Erkrankung, Herzerkrankungen, Immunsupression |
| Protokoll: | Eine Phase I Studie zur Beurteilung der Sicherheit und frühen Anzeichen der Wirksamkeit des humanen monoklonalen Antikörper-Zytokin Fusionsproteins IL12-L19L19. |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | |
| IMA402-101: IMA402 TCER® DOSISESKALATION (IMMATICS) | |
| IMA402 TCER® bei rezidivierenden und/oder refraktären soliden Tumoren | |
| Einschluss: | fortgeschr. und/oder metastasiertes Melanom (kutan, uveal), HLA-A*02:01 positiv, alle Standardtherapien ausgereizt, ≥1 messbare Läsion |
| Ausschluss: | Aktive Hirnmetastasen, Immunsupression, Autoimmunerkr., Herzerkrankungen, HIV/HBV/HCV, >4 systemische Vortherapien bei fortgeschr. Melanom (exkl. adj. Therapien) |
| Protokoll: | Eine klinische First-in-human Phase I/II-Studie zur Bewertung der Sicherheit, Verträglichkeit und Anti-Tumoraktivität von IMA402, einem bispezifischen T Cell-Enganging Receptor-Molekül (TCER®) gegen PRAME, in Patienten mit rezidivierenden und/oder refraktären soliden Tumoren. |
| Status: | 🟢 Rekrutierung offen |
| Details: clinicaltrials.gov | |
Basalzellkarzinom (Basaliom, BCC, weißer Hautkrebs)
| CEMI-FIRST: CEMIPLIMAB BEI FORTGESCRITTENEM BASALZELLKARZINOM (DeCOG) | |
| Bewertung von Cemiplimab als Erstlinientherapie bei fortgeschrittenem Basalzellkarzinom | |
| Einschluss: | histol. bestätigtes BCC, lokal fortgeschrittenes Stadium ohne Fernmetastasen mit fehlender Möglichkeit der Operation oder Strahlentherapie, keine schweren Begleiterkrankungen, ECOG 0/1 |
| Ausschluss: | Vortherapie mit Immuntherapie (wie PD-1/PD-L1 oder CTLA-4) oder zielgerichteter Therapie (wie Hedgehog-Inhibotoren), andere Neoplasien und Gorlin-Goltz-Syndrom, aktive Autoimmunerkr., Immunsuppression, schwere Herzerkrankung, behandlungswürdige Infektionen wie HIV/HBV/HCV |
| Protokoll: | Untersuchung der Wirksamkeit und Sicherheit von Cemiplimab als Erstlinienbehandlung für Patienten mit fortgeschrittenem Basalzellkrebs (CEMI-FIRST) – Eine offene, einarmige, prospektive Phase-II-Studie des DeCOG Netzwerks. |
| Status: | 🟡 in Vorbereitung |
| Details: euclinicaltrials.eu | |