Klinische Studien
Neue Therapieformen
Beteiligung an klinischen Studien
Heute selbstverständliche Leistungen der modernen Medizin waren vor wenigen Jahren teilweise noch nicht vorstellbar. Von dieser kontinuierlichen Zunahme der Kompetenz eines medizinischen Fachs hat auch die Urologie sehr profitiert.
So können heute bei regelrecht durchgeführter Vorsorge fast alle Tumore der Prostata in einem frühen und damit behandelbaren Stadium diagnostiziert werden. Ein anderes eindrucksvolles Beispiel ist der Fortschritt bei der Behandlung von Hodentumoren. Während in der Vergangenheit von Patienten mit Hodentumoren nur 5 – 10% der Betroffenen überlebten, sind heute Heilungsraten von über 95 Prozent möglich. Die Erfolge der Tumortherapie in den letzten Jahren und Jahrzehnten beruhen vor allem auf der Perfektionierung von Operationsmethoden sowie der systematischen Weiterentwicklung der Chemo- und Strahlentherapie.
Der medizinisch urologische Fortschritt ist nicht nur auf die Therapie bösartiger Tumore begrenzt. Auch für die Behandlung angeborener oder erworbener anatomischer Defekte (z.B. Hypospadie) oder von Funktionsstörungen (z.B. Inkontinenz) werden kontinuierlich neue konservative und operative Therapieformen entwickelt.
Diese Weiterentwicklung von bisherigen Standarttherapien erfolgt in sog. klinischen Studien, mit dem Ziel, eine Optimierung der Effektivität bei minimalen Nebenwirkungen zu erreichen. Um dementsprechend neue Behandlungsmöglichkeiten und Konzepte zu entwickeln, beteiligt sich die Urologische Universitätsklinik Heidelberg an nationalen und internationalen klinischen Studien.
KLINISCHE STUDIEN - PROSTATAKREBS
KLINISCHE STUDIEN - NIERENZELLKREBS
SWITCH 2
-- Studie geschlossen --
Sequenzielle, randomisierte, offene Phase III Studie zur Untersuchung der Wirksamkeit und Sicherheit von Sorafenib gefolgt von Pazopanib im Vergleich zu Pazopanib gefolgt von Sorafenib bei der Behandlung des fortgeschrittenen / metastasierten Nierenzellkarzinoms
Studienpopulation:
metastasiertes / fortgeschrittenes Nierenkrebs (alle Histologien)
Medikation:
Arm 1:
Sorafenib 400 mg bid oral bis zur Progression oder intolerabler Toxizität, gefolgt von Pazopanib 800 mg einmal täglich oral bis zur Progression oder intolerabler Toxizität
Arm 2:
Pazopanib 800 mg einmal täglich oral bis zur Progression oder intolerabler Toxizität, gefolgt von Sorafenib 400 mg bid oral bis zur Progression oder intolerabler Toxizität
Metastasiertes Nierenzellkarzinom
-- Studieneinschluss abgeschlossen --
RECAP- Reduktion von Tyrosinkinase Therapie abhängiger Müdigkeit durch Krafttraining
Prinzip
Unter einer zielgerichteten Therapie mit Tyrosinkinase Inhibitoren (Sutent®, Votrient®) können starke Müdigkeiten und Schwäche auftreten. Ein Sportprogramm mit progressivem Kraftraining kann diese Nebenwirkungen verhindern und dadurch eine erfolgreichere Therapie möglich machen. Mehr lesen..
Neoadjuvante Behandlung des Nierenzellkarzinoms mit Sorafenib (Nexavar)
-> Studie abgeschlossen
Die PREST-Studie
Hintergrundinformationen:
Die Mehrheit der Patienten mit Nierenkarzinom kann durch eine rechtzeitige Entfernung der tumortragenden Niere bzw. einer Tumorentfernung geheilt werden. Das Nierenkarzinom ist jedoch eine bösartige Erkrankung mit der Eigenschaft, frühzeitig und oft zunächst auch für die Ausbreitungsdiagnostik noch unbemerkt, Tochtergeschwülste auszubilden. Es liegt daher nahe, bei Patienten mit hohem Risiko des Voranschreitens des Nierenkarzinoms so früh wie möglich die Unterdrückung von Tumorwachstum und Metastasenbildung zu versuchen. Das kann mit Hilfe von Arzneimitteln realisiert werden, die bereits ihre Wirksamkeit und Sicherheit in klinischen Studien bei Bekämpfung von bereits ausgebildeten Metastasen gezeigt haben, beispielsweise mit dem Medikament Nexavar. Der antitumoralen Wirkung des Nexavar kann hierbei vermutlich sein wesentlicher Wirkmechanismus zugute kommen: die Hemmung von Faktoren (HIF-1 und HIF-2), die es dem Tumor ermöglichen neue Blutgefäße auszubilden und somit weiter zu wachsen. So soll eine Hemmung des Tumorwachstums erreicht werden. Mehr lesen ...
Nierenzellkarzinom
-> Studie abgeschlossen
Die SWITCH- Studie – Eine randomisierte, sequenzielle, offene Studie der Phase III zur Untersuchung der Wirksamkeit und Sicherheit von Sorafenib gefolgt von Sunitinib, im Vergleich zu Sunitinib gefolgt von Sorafenib, in der Erstlinientherapie des fortgeschrittenen/metastasierten Nierenzellkarzinoms
Ziel der Studie
Eingeschlossen werden Patienten mit metastasiertem/fortgeschrittenem Nierenzellkarzinom (alle Histologien), bei denen eine Zytokin-Therapie versagt hat, oder die für eine solche Therapie nicht geeignet sind. Mehr lesen…
Nierenzellkarzinom
-> Studie abgeschlossen
Die SMAT-Studie – Prospektiv randomisierte multizentrische Phase-2-Studie zur Metastasenresektion von Lungenfiliae (poor-prognosis) beim klarzelligen Nierenzellkarzinom +/- adjuvante Sunitinibtherapie über 1 Jahr
Ziel der Studie
Eingeschlossen werden Patienten mit >/= 2 synchronen oder innerhalb von 24 Monaten nach Nephrektomie aufgetretenen Lungenmetastasen. Mehr lesen…
Optimierung der Behandlung des metastasierten Nierenzellkarzinoms mit sog. mTor-Antagonisten (Follow-Up)
-> Follow-Up
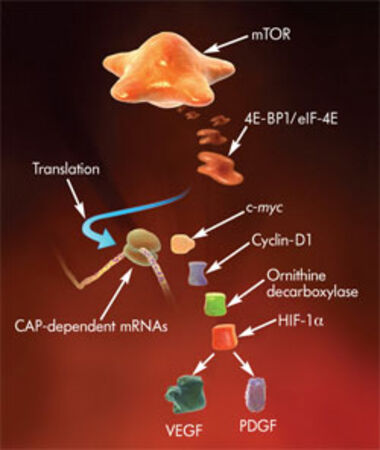
Die Temsirolimus®-Studie
Hintergrundinformationen:
In der Behandlung des metastasierten Nierenzellkarzinoms ist bislang die Gabe von immunstimulierenden Medikamenten, sog. Zytokinen (Interleukin-2; Interferon-alpha) oder die Anwendung sog. „zielgerichteter Therapien“ mit den beiden klinisch angewendeten “Tyrosinkinaseinhibitoren” Sutent® und Nexavar® die Therapie der Wahl im klinischen Alltag.
Wenn es jedoch unter der o.g. Behandlung zu einem Voranschreiten des Tumors kommt und die angewendete Therapie nicht mehr wirksam ist, steht seit neuestem das kürzlich zugelassene Medikament Temsirolimus® an unserer Klinik für Patienten mit einem metastasierten Nierenzellkarzinom zu Verfügung. Bei Temsirolimus® handelt es sich um einen neuen Wirkstoff, welcher die Krebszellen in Ihrer Teilung und Vermehrung hemmen soll. Dabei werden verschiedene Signalmoleküle (m-Tor, mammalian target of rapamycin) gehemmt, die an der Teilung der Zelle beteiligt sind. Mehr lesen ...
ARISER- Studie
-> Studie abgeschlossen
Phase III Studie zur Therapie des klarzelligen Nierenzellkarzinoms
Randomisierte Studie zur adjuvanten Therapie des klarzelligen Nierenzellkarzinoms mit dem Antikörper cG250 (ARISER- Studie) richtet sich an alle Patienten mit einem klarzelligen Nierenzellkarzinom, bei denen der Tumor operativ entfernt wurde und bei denen keine Fernabsiedelung (Metastasierung) des Tumors vorliegt. Aufgrund des vorliegenden Risikoprofils, welches sich während der Operation und in der nachfolgenden Feingewebsuntersuchung zeigt, besteht jedoch möglicherweise ein erhöhtes Risiko für ein Rezidiv (Neuauftreten) des Nierenzellkarzinoms. Ziel dieser randomisierten verblindeten Phase III Studie ist die Beurteilung der Wirksamkeit einer adjuvanten Therapie mit dem Antikörper cG250 (Rencarex®) im Vergleich zum Placebo, um ein mögliches Rezidiv des Tumors zu vermeiden. mehr ...
KLINISCHE STUDIEN - BLASENKREBS
POTOMAC
-- Rekrutierung läuft --
Eine randomisierte, unverblindete, multizentrische, weltweit durchgeführte Studie der Phase III von Durvalumab und Bacillus Calmette-Guérin (BCG) verabreicht als Kombinationstherapie im Vergleich zu BCG alleine bei Patienten mit Hochrisiko nicht-muskelinvasivem Blasenkarzinom (POTOMAC)
Beschreibung:
Dies ist eine randomisierte, unverblindete, multizentrische, weltweit durchgeführte Phase III Prüfung, um die Wirksamkeit und Sicherheit der Kombinationstherapie bestehend aus Durvalumab und BCG bei der Behandlung von Patienten mit nicht-muskelinvasivem Blasenkarzinom zu ermitteln. Patienten werden den Behandlungsoptionen der Durvalumab + BCG Kombinationstherapien, oder der Standard of Care (SoC) Therapie zufällig zugeordnet.
DANBUE
-- Follow Up --
Eine Phase III, randomisierte, unverblindete, multizenterische, globale Studie zur Bewertung einer Erstlinientherapie mit Durvalumab als Einzelwirkstoff und Durvalumab in Kombination mit Tremelimumab gegenüber der Standard-Chemotherapie bei Patienten mit einem inoperablen Grad 4 Urothelkarzinom.
Beschreibung:
Es handelt sich um eine randomisierte, unverblindete, kontrollierte, globale Multizenterstudie der Phase III zur Feststellung der Wirksamkeit und Sicherheit einer Durvalumab Monotherapie, und Durvalumab in Kombination mit Tremelimumab im Vergleich zur Standardtherapie (Cisplatin + Gemcitabin oder Carboplatin + Gemcitabin) als Erstlinientherapie bei Therapie-naiven Patienten mit einem histologisch oder zytologisch dokumentierten, inoperablen Transitionalzellkarzinom Grad 4 (Transitionalzellkarzinom und gemischte Transitional-/Nicht-Transitionalzellhistologien) des Urothels.




