AG Muskel
Muskel
Forschung: Skelettmuskel
Der Skelettmuskel zeigt eine faszinierende Plastizität: Masse, Struktur, Funktion und Stoffwechsel passen sich an unterschiedliche Trainingsformen an und ermöglichen hierdurch eine gesteigerte Leistungsfähigkeit. Umgekehrt zeigt der Skelettmuskel aber auch Anpassungsreaktionen an Inaktivität und krankheitsbedingte Veränderungen im Körper und kann Einfluss nehmen auf Prognose und Verlauf einer Erkrankung.
Im Mittelpunkt unserer bisherigen Forschung stand die muskuläre Adaptation an Krafttraining. Regelmäßiges Krafttraining bewirkt eine Muskelhypertrophie mit Zunahme des Muskelquerschnitts und des Muskelfaserquerschnitts, v.a. der schnellen Typ II Fasern.
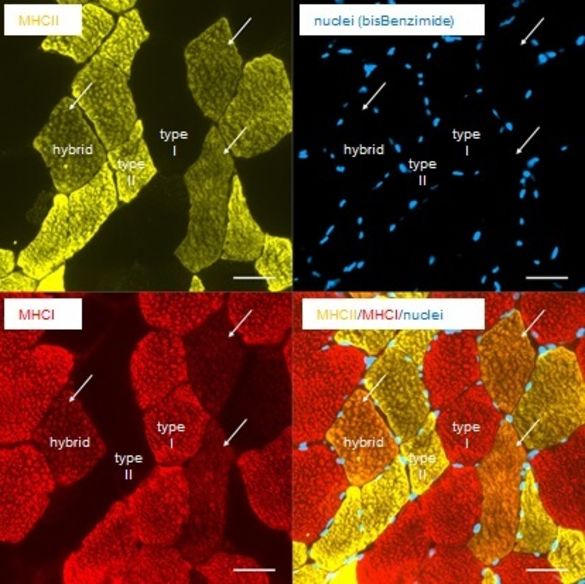
Immunhistochemische Färbungen an Gefrierschnitten von Biopsaten aus dem M. vastus lateralis
Darstellung von Satellitenzellen
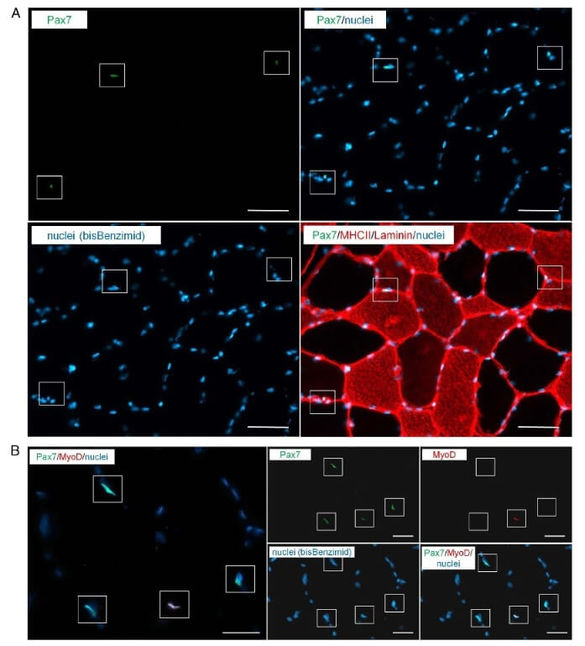
Vermittelt werden diese Anpassungsreaktionen durch eine Steigerung der Proteinsynthese, v.a. infolge einer gesteigerten Translation sowie durch Genexpressionsänderungen mit Aufregulierung von Muskelwachstums-Genen, Herunterregulierung von Genen, die das Muskelwachstum hemmen bzw. den Abbau von Muskelsubstanz fördern. Außerdem ändert sich das Expressionsmuster von Genfamilien, die die Ausbildung von langsamen und schnellen Muskelfasern fördern. Darüber hinaus kommt den Satellitenzellen, den Stammzellen des Skelettmuskels eine besondere Bedeutung zu. Die Satellitenzellen können durch einen Krafttrainingsreiz aktiviert werden, proliferieren und neue Zellkerne zur Verfügung stellen. Ob sie auch die Bildung neuer Muskelfasern bewirken können, ist noch umstritten.
In einer unserer ersten Studien konnte gezeigt werden, dass ein zusätzlich während eines Kraftausdauertrainings einwirkender Hypoxiereiz die muskuläre Adaptation an ein Kraftausdauertraining nicht verstärkt. In einer anderen Untersuchung konnten wir eine vermehrte Rekrutierung von Muskelfasern bei Durchführung eines Kniebeugentrainings auf einer Vibrationsplatte beobachten. Zuletzt gingen wir einer Beobachtung aus der Trainingspraxis nach, nämlich dass eine Erhöhung der exzentrischen Last während eines kombiniert konzentrisch exzentrischen Krafttrainings die Ausbildung eines schnelleren Muskelphänotyps fördert und konnten diese Beobachtung durch Feststellung typischer Änderungen in Muskelfaserquerschnitten und Genexpressionsänderungen untermauern.
Ausgewählte Publikationen
Friedmann, B., Kinscherf, R., Borisch, S., Richter, G., Bärtsch, P., Billeter, R.: Effects of low resistance - high repetition strength training in hypoxia on muscle structure and gene expression. Pflügers Arch. 446: 742-751, 2003.
Friedmann, B., Kinscherf, R., Vorwald, S., Müller, H., Kucera, K., Borisch, S., Richter, G., Bärtsch, P., Billeter, R.: Muscular adaptations to computer-guided strength training with eccentric overload. Acta Physiol. Scand.182: 77-88, 2004.
Friedmann-Bette, B., Bauer, T., Kinscherf, R., Vorwald, S., Klute, K., Weber, M.-A., Metz, J., Kauczor, H.-U., Bärtsch, P., Billeter, R.: Effects of strength training with eccentric overload on muscle adaptations in athletes. Eur. J. Appl. Physiol. 108: 821-826, 2010.
Betz, T. M., Wehrstein, M., Preisner, F., Bendszus, M., Friedmann-Bette, B.: Reliability and validity of a standardised ultrasound examination protocol to quantify vastus lateralis muscle. Journal of Rehabilitation Medicine, 53(7):jrm00212, 2021.
Preisner, F., Friedmann-Bette, B., Wehrstein, M., Vollherbst, D. F., Heiland, S., Bendszus, M., Hilgenfeld, T.: In Vivo Visualization of Tissue Damage Induced by Percutaneous Muscle Biopsy via Novel High-Resolution MR Imaging. Medicine and Science in Sports and Exercise, 53(7):1367-1374, 2021.
Friedmann-Bette, B., Lornsen, H., Parstorfer, M., Gwechenberger, T., Profit, F., Weber, M.-A., Barié, A.: Gene expression changes in vastus lateralis muscle after different strength training regimes during rehabilitation following anterior cruciate ligament reconstruction. PLoS ONE 16(10): e0258635, 2021.
Wehrstein, M., Schöffel, A., Weiberg, N., Gwechenberger, T., Betz, T., Rittweg, M., Parstorfer, M., Pilz, M., Friedmann-Bette, B.: Eccentric Overload during Resistance Exercise, Medicine & Science in Sports & Exercise. doi: 10.1249/MSS.0000000000002818. Epub ahead of print, 2021.
Eckhardt, H., Wollny, R., Müller, H., Bärtsch, P. Friedmann-Bette, B.: Enhanced myofibre recruitment during exhaustive squatting exercise performed as whole-body vibration training. J. Strength Cond. Res. 25: 1120-1125, 2011.
Friedmann-Bette, B., Schwartz, F.R., Eckhardt, H., Billeter, R., Bonaterra, G., Kinscherf, R.: Similar changes of gene expression in human skeletal muscle after resistance exercise and multiple fine needle biopsies. J. Appl. Physiol. 112: 289-295, 2012.
Friedmann-Bette, B., Profit, F., Gwechenberger, T., Weiberg, N., Parstorfer, M., Weber, M.A., Streich, N., Barié, A.: Strength Training Effects on Muscular Regeneration after ACL-Reconstruction. Med. Sci. Sports. Exerc. 50: 1152-1161, 2018.
Parstorfer, M., Profit, F., Weiberg, N., Wehrstein, M., Barié, A., Friedmann-Bette, B.: Increased satellite cell apoptosis in vastus lateralis muscle after anterior cruciate ligament reconstruction. J. Rehab. Med. 53: jrm00153. Doi:10.2340/16501977-2794, 2021.
Mitarbeiter
Arbeitsgruppenleiterin
-
Prof. Dr. med. Birgit Friedmann-Bette
Sportmedizin, Allgemeinmedizin, Physikalische Therapie und Balneologie