Molekulare Neuroonkologie der Sektion Neurochirurgische Forschung
Ziele und Forschungsschwerpunkte
MOLECULAR NEUROONCOLOGY
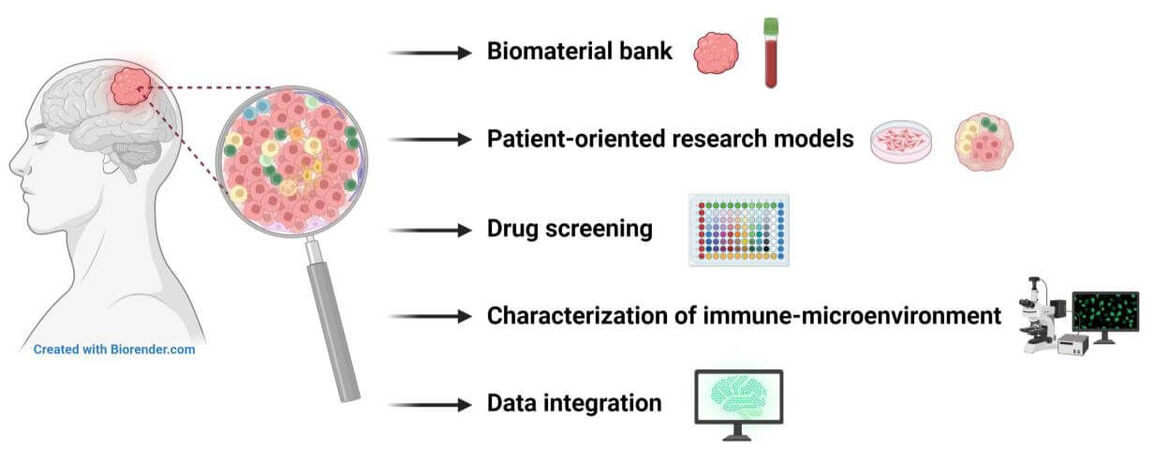
The treatment of brain tumors represents to date a major interdisciplinary challenge. In search for new therapeutic modalities, an improved in-depth characterization of brain tumor biology and the development of novel preclinical and patient-oriented research models is essential. Therefore, our research group focuses primarily on the:
- Establishment and steady expansion of a biomaterial bank for patient-derived tumor tissue and blood samples
- Development of patient-oriented research models
- Testing of anti-neoplastic drug libraries in large-scale in vitro drug screenings and predictive biomarkers
- Characterization of the tumor immune-microenvironment and development of immunotherapeutic treatment modalities
in various brain tumor entities including e.g. glioblastomas (IDHwt), lower-grade-gliomas (IDHmut), ependymomas, brain metastases (breast, lung, melanoma), meningiomas, lymphomas and chordomas.
Our research group has long-standing expertise in a variety of experimental techniques including:
- Establishment and validation of patient-oriented in vitro research 2D and 3D cell models including primary tumor cell cultures and tumor stem cell lines as well as tumor organoids as patient-derived mini avatars
- Implementation of large-scale (semi-automated) in vitro drug screenings for single or combinatorial treatment using established and primary tumor cell cultures and tumor organoids for personalized drug testing
- Quantification and phenotyping of immune cell infiltrates in cryo-preserved tumor tissue slides by multiplexed immunofluorescence staining (tissue cytometry)
- Experimental in vitro testing of immunotherapeutic drugs using patient-derived immune cells from tumor cell suspensions as well as blood-born leukocytes
- Integration of multi-omics data including genome, transcriptome and proteome
as well as practical experience with and access to state-of-the-art methodologies, e.g. nanopore-sequencing, single-cell/single-nuclei RNA sequencing and spatial transcriptomics at the campus site.
MOLEKULARE NEUROONKOLOGIE
Die Behandlung von Hirntumoren stellt bis heute eine große interdisziplinäre Herausforderung dar. Auf der Suche nach neuen Therapiemodalitäten ist eine verbesserte und tiefgreifende Charakterisierung der Hirntumorbiologie und die Entwicklung neuartiger präklinischer und Patienten-naher Forschungsmodelle von entscheidender Bedeutung. Daher konzentriert sich unsere Forschungsgruppe vor allem auf:
• den Aufbau und stetigen Ausbau einer Biomaterialbank für humane Tumorgewebe- und Blutproben
• die Entwicklung von Patienten-nahen Forschungsmodellen
• die Testung anti-neoplastischer Arzneimittelbibliotheken in groß angelegten in-vitro-Arzneimittelscreenings und die Untersuchung prädiktiver Biomarker
• die Charakterisierung der Immun-Mikroumgebung des Tumors und die Entwicklung von immuntherapeutischen Behandlungsmodalitäten
bei verschiedenen Hirntumorentitäten, darunter z.B. Glioblastome (IDHwt), niedrig-gradige Gliome (IDHmut), Ependymome, Hirnmetastasen (Brust, Lunge, Melanom), Meningeome, Lymphome und Chordome.
Unsere Forschungsgruppe verfügt über langjährige Erfahrung in einer Vielzahl experimenteller Techniken, darunter:
• die Etablierung und Validierung von humanen in-vitro 2D- und 3D-Zellmodellen einschließlich primärer Tumorzellkulturen und Tumorstammzelllinien sowie Tumor-Organoiden als Patienten-spezifische Mini-Tumor-Avatare
• die Durchführung groß angelegter (halb-automatisierter) in-vitro-Arzneimittelscreenings für Einzel- oder Kombinationsbehandlungen unter Verwendung etablierter und primärer Tumorzellkulturen und Tumor-Organoiden für personalisierte Arzneimitteltests
• die Quantifizierung und Phänotypisierung von Immunzellinfiltraten in kryo-konservierten Tumorgewebeschnitten durch Multiplex-Immunfluoreszenzfärbung (Gewebe-Zytometrie)
• experimentelle in-vitro-Tests von Immuntherapeutika unter Verwendung Patienten-eigener Immunzellen aus Tumorzellsuspensionen sowie aus dem Blut stammende Leukozyten
• die Integration von Multi-Omics-Daten einschließlich Genom, Transkriptom und Proteom
sowie praktische Erfahrung und Zugang zu modernsten Methoden, z.B. Nanopore-Sequenzierung, Einzel-Zell-/Einzel-Zellkern-RNA-Sequenzierung und „Spatial Transcriptomics“ (räumliche Transkriptom-Analyse im Gewebeschnitt) auf dem Campus-Gelände.