Forschungsschwerpunkte
Die beiden Hauptziele unserer Abteilung sind es durch frühe klinische Arzneimittelstudien (Early Clinical Trials, ECT) sowie durch die Analyse und Qualifizierung von Arzneistoffen in unseren Laboren die Translation neuer Therapien in den Menschen zu fördern und die Arzneimitteltherapiesicherheit (AMTS) bereits zugelassener Therapien zu maximieren. Im Fokus stehen die im Folgenden aufgeführten Schlüsseltechnologien und Forschungsexpertisen sowie unser engagiertes, multidisziplinäres Team von erfahrenen Mitarbeiter/innen.
Fokus Early Clinical Trials
Frühe klinische Arzneimittelstudien / Erstanwendungen (First-in-Human-Studien)
Hintergrund: Die klinische Arzneimittelentwicklung beginnt mit einer First-in-human (FIH)-Studie. Unter maximalen Sicherheitsvorkehrungen durchgeführt, informieren FIH-Studien über dosisabhängige Verträglichkeit, Pharmakokinetik und ggf. auch erste pharmakodynamische Aspekte und sie legen fest, welche Dosen künftig geprüft werden sollen. Die Entwicklung von 33 % aller neuen Arzneistoffe scheitert in dieser Stufe.
Erfahrung: ~ 40 FIH-Studien in den letzten Jahren
Ansprechpartnerin: PD Dr. med. Antje Blank
Beteiligter Abteilungsbereich: Klinisch-Pharmakologisches Studienzentrum
Qualitative und quantitative Beschreibung von Arzneimittel-Wechselwirkungen in vivo und in vitro
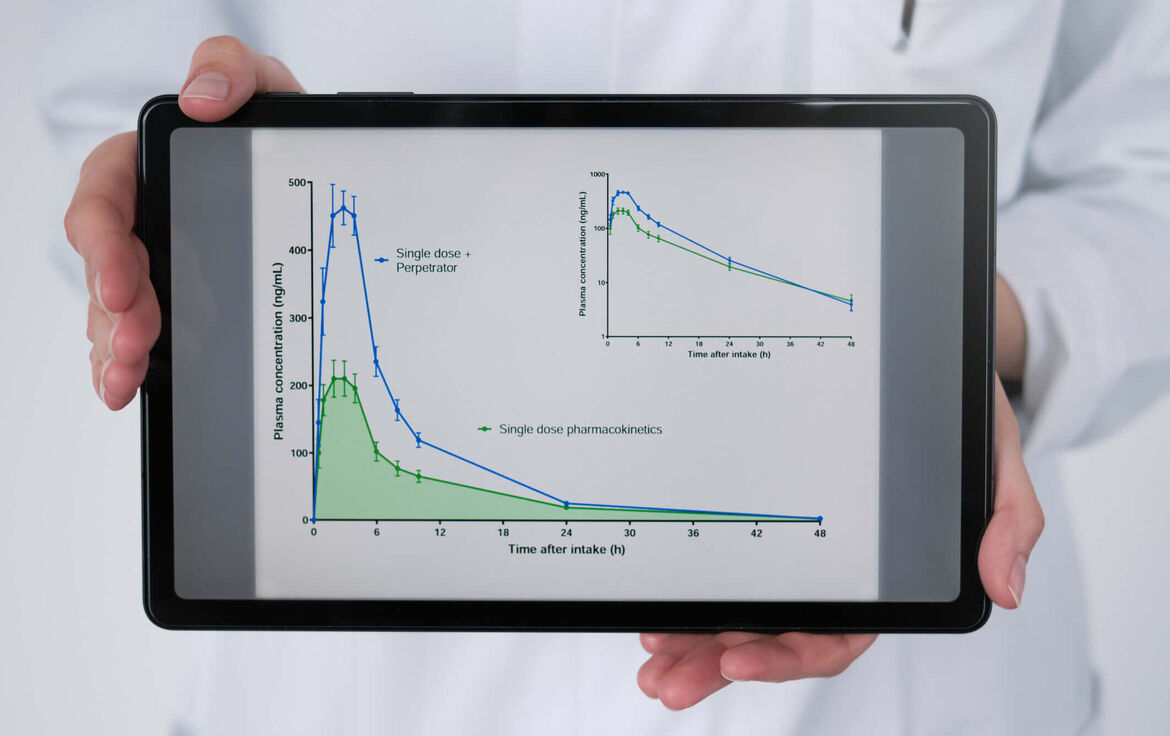
Hintergrund: Wechselwirkungen zwischen Arzneimitteln können deren Wirkung aufheben oder in toxische Bereiche verstärken und deshalb Dosisanpassungen oder Vermeidungsstrategien bedingen. Wechselwirkungen können aber auch notwendig sein, um überhaupt erst eine Wirkung zu entfalten. Fundiertes quantitatives Wissen über Wechselwirkungen von Arzneimitteln ist daher essenziell, um Arzneimittel sicher und wirksam zu kombinieren.
Erfahrung: > 45 Klinische DDI-Studien und > 40 DDI-In-vitro-Studien
Ansprechpartnerin: PD Dr. med. Antje Blank
Beteiligte Abteilungsbereiche:
Klinisch-Pharmakologisches Studienzentrum Analytisch-Chemisches Labor Molekularbiologisch-Biochemisches Labor Pharmakoepidemiologie Arzneimittel-Anwendung- und Sicherheit
Mikrodosierung
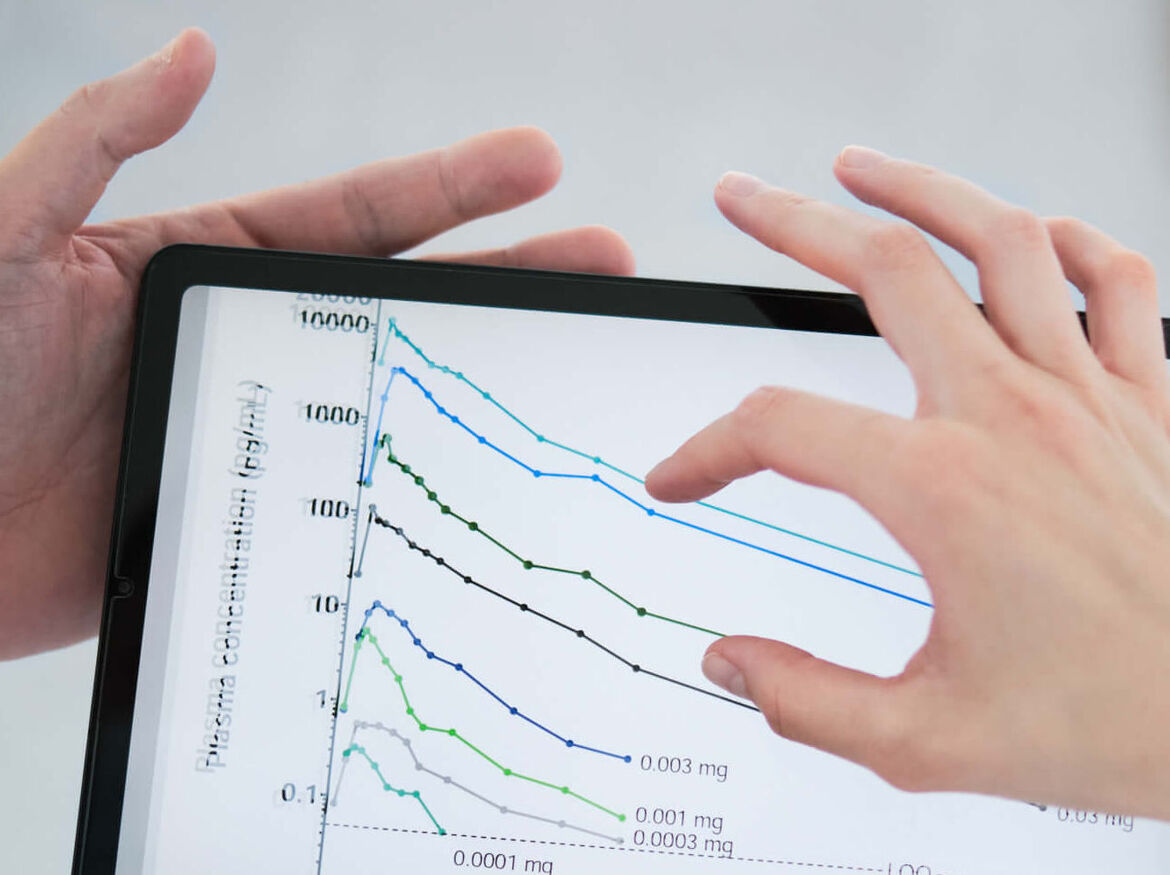
Hintergrund: Bei ausreichender analytischer Sensitivität können Arzneistoffe pharmakokinetisch charakterisiert werden, selbst wenn sie in Dosierungen verabreicht werden, die unterhalb des NOEL (No Observed Effect Level) liegen bzw. maximal 1 % einer therapeutischen Dosis betragen (typischerweise < 100 ng). Außerdem können mikrodosierte Opfersubstanzen einzeln oder auch als Cocktail verwendet werden, um Wechselwirkungen mit (normal dosierten) Tätersubstanzen zu erfassen und so auch bei Polypharmazie-Patienten risikoarm eingesetzt werden.
Erfahrung: > 20 klinische Studien mit mikrodosierten Arzneimitteln, validierte Analytik für 7 mikrodosierte Testsubstrate
Ansprechpartnerin: PD Dr. med. Antje Blank
Beteiligte Abteilungsbereiche: Klinisch-Pharmakologisches Studienzentrum Analytisch-Chemisches Labor
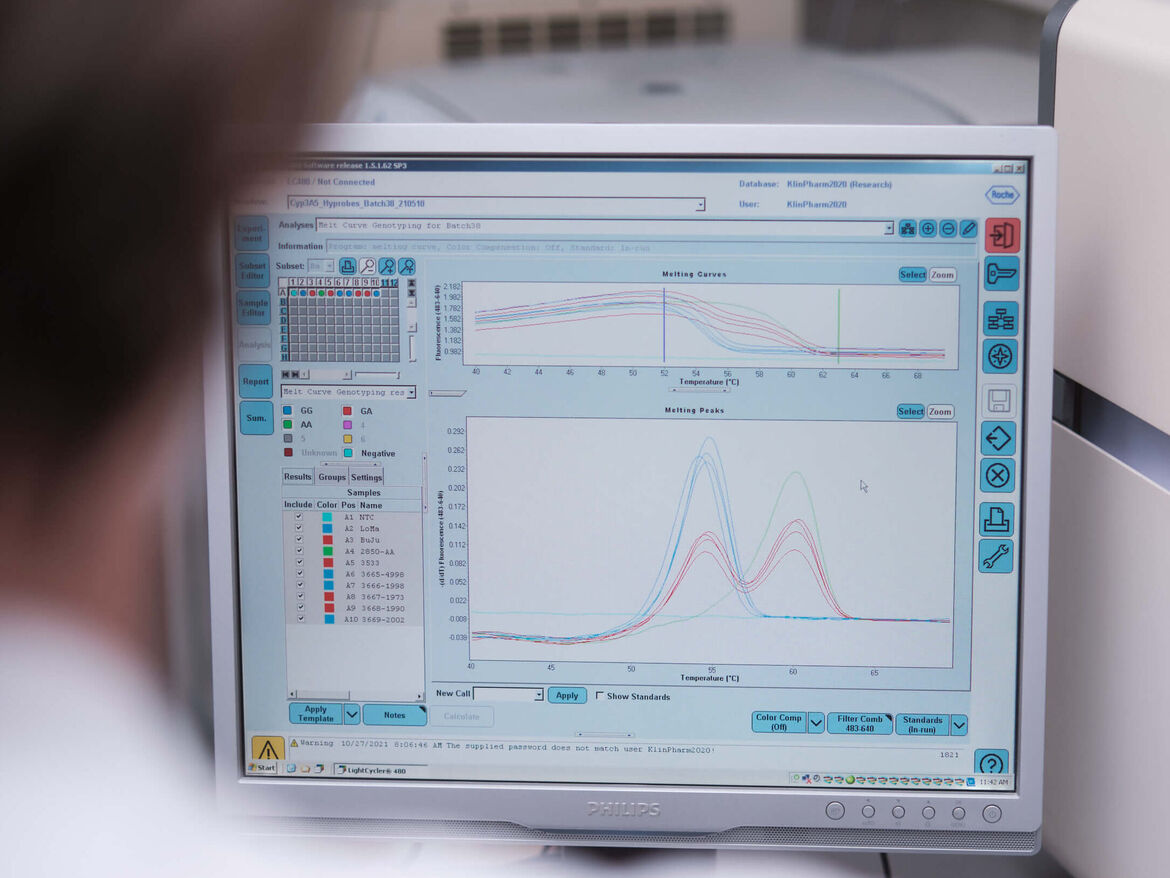
Einfluss von genetischen Polymorphismen auf die Pharmakokinetik von Arzneistoffen
Hintergrund: Genetische Unterschiede in arzneistoffmetabolisierenden Enzymen oder Transportern können die Pharmakokinetik von Arzneistoffen und auch deren Wechselwirkungspotential beeinflussen. All dies kann den Dosisbedarf des Einzelpatienten erheblich verändern und deshalb von klinischer Relevanz sein.
Ansprechpartnerin: PD Dr. med. Antje Blank
Beteiligte Abteilungsbereiche: Klinisch-Pharmakologisches Studienzentrum Analytisch-Chemisches Labor Molekularbiologisch-Biochemisches Labor
Pharmakokinetik und Pharmakodynamik von Immunsuppressiva und bei Niereninsuffizienz
Hintergrund: Spezielle Patientenpopulationen (z. B. Patienten mit Niereninsuffizienz, transplantierte Patienten mit Immunsuppression) erfordern stark individualisierte Dosierungen um Wirksamkeit zu gewährleisten und Toxizität zu vermeiden. Deshalb ist es wichtig Einflussfaktoren (z. B. Wechselwirkungen) zu verstehen und Strategien zur Überwachung und Optimierung der individuellen Therapie (maßgeschneiderte Therapie) weiterzuentwickeln.
Ansprechpartner: Prof. Dr. med. David Czock PD. Dr. med Antje Blank
Beteiligte Abteilungsbereiche: Arzneimittel-Anwendung- und Sicherheit Klinisch-Pharmakologisches Studienzentrum
Fokus Arzneimittelanalytik und -quantifizierung
Neue Darreichungsformen (Oralisierung von Peptiden, 2D-Druck)
Hintergrund: Um die orale Bioverfügbarkeit von Peptid-Arzneimitteln zu verbessern und eine langfristige parenterale Verabreichung zu umgehen, entwickeln wir aktive, resorptionsverstärkende Hilfsstoffe und testen sie in Tiermodellen und klinischen Studien.
Parallel werden Arzneistoffe mit individuell hochvariablem Dosierungsbedarf in 2-dimensionalen Druckverfahren auf orodispersible Filme gedruckt und deren systemische Verfügbarkeit und Schleimhautpermeabilität bei Erwachsenen und Kindern getestet.
Erfahrung: Mikro- und normaldosierte orodispersible Filme, 1 neuer aktiver Hilfsstoff in Entwicklung
Ansprechpartner: Dr. Jürgen Burhenne
Beteiligte Abteilungsbereiche: Analytisch-Chemisches Labor Klinisch-Pharmakologisches Studienzentrum
Hochempfindliche Arzneistoffquantifizierung
Hintergrund: Validierte analytische Methoden mit höchster Empfindlichkeit (z. T. femtomolare Nachweisgrenzen) sind eine Voraussetzung um Arzneistoffe nach Gabe von Mikrodosen oder in sehr kleinen Probenvolumina zu quantifizieren. Letzteres können Proben von Frühgeborenen, Kleintieren, Trockenblutproben (Dried-blood-spots) oder (mikrodissektierte) Gewebeproben sein.
Erfahrung: Validierte ultrasensitive Analytik für 7 Testsubstrate
Ansprechpartner: Dr. Jürgen Burhenne
Beteiligter Abteilungsbereich: Analytisch-Chemisches Labor
Intrazelluläre Pharmakokinetik und Pharmakodynamik
Hintergrund: Für die Wirkung eines Arzneistoffs stellen Plasmakonzentrationen häufig kein gutes Surrogat dar, vielmehr ist die Konzentrationen am Wirkort, d. h. meist in der Zielzelle entscheidend. Wir untersuchen daher intrazellulär die Zusammenhänge zwischen lokaler Konzentration und lokal erzielter oder systemischer Wirkung.
Ansprechpartnerin: Prof. Dr. rer. nat. Johanna Weiß
Beteiligter Abteilungsbereich: Molekularbiologisch-Biochemisches Labor
Fokus Arzneimitteltherapiesicherheit
Stärkung der Patientenkompetenzen und Förderung einer patientenzentrierten AMTS
Hintergrund: Für Patienten ist die Einnahme von Arzneimitteln oft kompliziert, aufwändig und mit Nebenwirkungen verbunden. Deshalb und weil die Motivation und gute Adhärenz der Patienten gerade bei Langzeittherapien erfolgsentscheidend ist, sollten die Durchführung der eigenen Therapie klar sein und den Gesundheitsbedürfnissen der Patienten gut entsprechen. Individuelle Patientenpräferenzen und Informationsbedarfe verlässlich zu erheben und entsprechend zu adressieren ist das Ziel dieser Forschungsarbeiten.
Ansprechpartnerin: Prof. Dr. sc. hum. Hanna M. Seidling
Beteiligter Abteilungsbereich: Kooperationseinheit Klinische Pharmazie
Interprofessionelle Zusammenarbeit und Maßnahmen zur Verbesserung der AMTS
Hintergrund: In jeder Arzneimitteltherapie können alle Schritte des Medikationsprozesses zu Hürden der Therapietreue (Adhärenz) und Risiken werden. Oft sind in die Versorgung mehrere Heilberufsgruppen involviert, deren Dienste parallel oder konsekutiv gut koordiniert werden müssen. Wir führen ausführliche Prozessanalysen vor Ort durch, die einen Ausgangspunkt für die Auswahl, Entwicklung, Pilotierung, Implementierung und Analyse von (häufig digitalen) AMTS-Maßnahmen bilden. Außerdem entwickeln wir Wege zur Optimierung der interprofessionellen Zusammenarbeit und AMTS-Werkzeuge für den stationären und ambulanten Bereich.
Ansprechpartnerin: Prof. Dr. sc. hum. Hanna M. Seidling
Beteiligter Abteilungsbereich: Kooperationseinheit Klinische Pharmazie
Elektronische Entscheidungsunterstützung und Wissenstransfer im AMTS-Bereich
Hintergrund: Elektronische Informationsquellen und Entscheidungsunterstützung haben die Fehlervermeidung im Medikationsprozess revolutioniert. Aktualität, inhaltliche Qualität und Treffgenauigkeit von Warnhinweisen sind Kernelemente einer guten AMTS-Software, die darüber hinaus möglichst tief integriert in den Prozess integriert sein muss, dessen Risiken minimiert werden sollen. Seit Jahrzehnten entwickeln wir zusammen mit künftigen Anwendern elektronische Werkzeuge für Heilberufler und Patienten und pilotieren deren Alltagstauglichkeit, bevor sie dann in der Fläche zur Anwendung kommen (z. B. in AiDKlinik). Over-Alerting zu vermeiden ist dabei ein wichtiges Ziel.
Erfahrung:
Ansprechpartner: Dipl.-Inform. Med. Michael Metzner
Beteiligter Abteilungsbereich:
Medizinische Informationstechnologie
Real-World-Evidence in großen Datenbanken
Hintergrund: Aus großen Datenquellen, wie z. B. Routinedaten von Krankenkassen, werden Wirksamkeit (comparative effectiveness research) bestimmter Therapiestrategien untersucht. Darüber hinaus werden unerwünschte Arzneimittelwirkungen analysiert, die auch Sicherheitsfragen von Ereignissen mit geringer Prävalenz oder Risiken von Arzneimittelkombinationen (Wechselwirkungen) untersuchen lassen.
Ansprechpartner: PD Dr. sc. hum. Andreas Meid
Beteiligter Abteilungsbereich: Pharmakoepidemiologie
Pharmakometrie und Quantitative Systems Pharmacology
Hintergrund: Basierend auf Modellen zur Pharmakokinetik (Populationspharmakokinetik, physiologie-basierte Pharmakokinetik) werden Arzneimittelkonzentrationen und -effekte über die Zeit modelliert, mögliche Therapieschemata simuliert und gegebenenfalls gestützt auf (Konzentrations- oder Biomarker-) Messungen monitoriert.
Ansprechpartner: PD Dr. sc. hum. Andreas Meid
Beteiligter Abteilungsbereich: Pharmakoepidemiologie