Klinische Forschergruppe (KFO 227)
Titel: Colorectal Cancer: From primary tumor progression towards metastases
Sprecher: Prof. Dr. M.W. Büchler
Koordinator: PD Dr. Martin Schneider
Laufzeit: 01.10.2009 bis 30.09.2015
Förderung: 1 100 000 €/Jahr durch die Deutsche Forschungsgemeinschaft (DFG) und Medizinische Fakultät Heidelberg
Website: www.kfo227.de
Zusammenfassung der klinischen Forschergruppe
Metastasen (d.h. Tochtergeschwülste) stellen die Haupttodesursache bei Patienten mit einem kolorektalen Karzinom dar. Ein eingehendes Verständnis der Mechanismen, die der metastatischen Ausbreitung kolorektaler Tumorzellen zu Grunde liegen, bietet daher eine Basis für neue, innovative Therapiekonzepte.
Die Klinische Forschergruppe 227 (KFO 227) dient der Aufklärung des komplexen Prozesses der Metastasenentstehung, welche sich in mehreren Schritten vollzieht (metastatische Kaskade, siehe Abb. 1): Zunächst bewirken bestimmte genetische Veränderungen einen pro-metastatischen Phänotyp von Tumorzellen, welcher unter anderem mit der Fähigkeit zu infiltrativem Wachstum und zur Invasion benachbarter Blut- oder Lymphgefäße verbunden ist. In der Folge erreichen Tumorzellen das Blutgefäßsystem, wo sie als zirkulierende Tumorzellen (CTCs) transportiert werden. CTCs können sich als disseminierte Tumorzellen (DTCs) in entfernten Organen niederlassen und ruhen, ohne dabei ihr metastatisches Potential zu verlieren. Schließlich wandern CTCs am Ort der Metastasenentstehung aus dem Blutgefäßsystem aus (Extravasation). Um hier zu einer Metastase auswachsen zu können, benötigen sie ein Selbsterneuerungspotential, welches sogenannten Tumor Initiating Cells (TICs) zu eigen ist. Während des gesamten Prozesses der Metastastenentstehung müssen Tumorzellen der Immunabwehr entgehen.
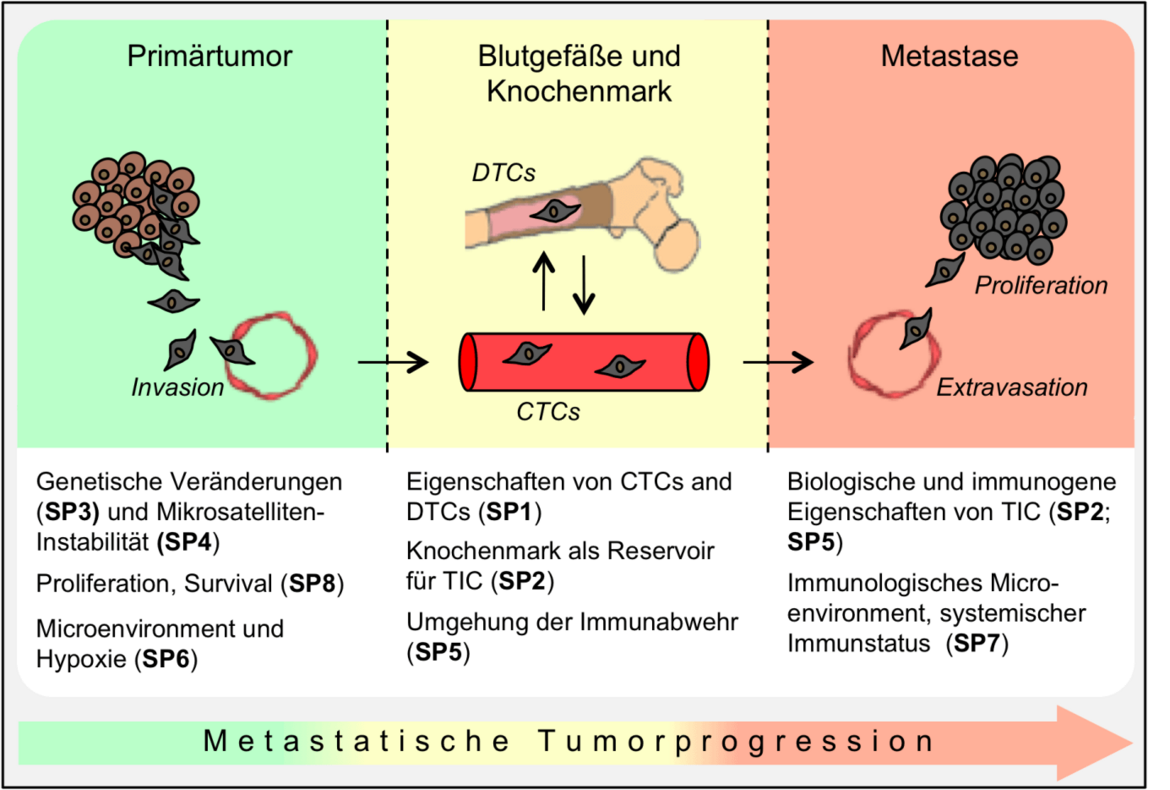
Die KFO 227 ist ein Zusammenschluss von Ärzten und Wissenschaftlern aus den Bereichen der Tumorchirurgie, der Onkologie, Pathologie, translationalen Onkologie, Stammzellbiologie, Molekulargenetik und der Tumorimmunologie (Abb. 2). Insgesamt wurden acht Subprojekte (SP1-8) definiert, welche sich spezifisch mit relevanten Ereignissen der metastatischen Kaskade befassen: Welche genetischen und epigenetischen Veränderungen von Tumorzellen begünstigen die Metastasenentstehung (SP3; SP4), und welche Merkmale zeichnen TICs aus (SP2)? Welche molekularen Mechanismen regulieren das infiltrative Wachstum und das Überleben von Tumorzellen (SP8), und wie werden sie durch das hypoxische Tumormilieu beeinflusst (SP6)? Welche biologischen Eigenschaften liegen dem tumorigenen Potential von CTCs und DTCs zugrunde (SP1)? Schließlich: wie interagieren lokale und systemische Immunantworten während der Metastasenbildung (SP4; SP5), und wie können metastasierende Tumorzellen der Überwachung durch das Immunsystem entgehen (SP5)? Die Arbeiten aller Subprojekte beruhen auf Tumorproben von denselben Patienten. Dadurch ist es möglich, ein umfassenderes biologisches und molekulares Verständnis der Tumorprogression und metastatischen Kaskade für den einzelnen Patienten zu entwickeln.
Im Jahr 2012 wurde nach erfolgreicher Zwischenbegutachtung von Seiten der DFG eine zweite Förderperiode für die KFO 227 bewilligt.
Teilprojekte der Klinischen Forschergruppe 227
C-Projekt: Prof. Dr. M. W. Büchler, PD Dr. M. Schneider - Chirurgische Klinik - Das C-Projekt unterstützt durch Unterhaltung einer zentralen Gewebe- und Datenbank sowie durch biostatistische Auswertung der klinischen und experimentellen Daten aller untersuchten Patienten die Teilprojekte. Weiterhin ist das C-Projekt für die Koordination der wissenschaftlichen Aktivitäten innerhalb der KFO und für die strukturierte Ausbildung der Nachwuchswissenschaftler verantwortlich. |
Teilprojekt 1: Prof. Dr. J. Weitz, MSc, Prof. Dr. M. Koch - Chirurgische Klinik Dresden - Teilprojekt 1 beschäftigt sich mit der Isolierung, Langzeitkultivierung und genetischen Charakterisierung zirkulierender und disseminierter Tumorzellen mit besonderem Fokus auf tumorinitiierenden Eigenschaften dieser Zellen. |
Teilprojekt 2: Dr. C. Ball, Prof. Dr. H. Glimm - Abteilung Translationale Onkologie, NCT - Teilprojekt 2 analysiert die funktionelle Heterogenität des tumor-initiierenden Zellkompartiments sowie genetische Veränderungen, die zu Selbsterneuerung und Metastasierung von tumor-initiierenden Zellen (TIC) führen. |
Teilprojekt 3: Prof. Dr. P. Lichter, PD Dr. M. Rogers, Dr. B. Radlwimmer - Abteilung Molekulare Genetik, DKFZ - Teilprojekt 3 beschäftigt sich mit der funktionellen Analyse stammzell-assoziierter Gene, die für die Tumorprogression und Metastasierung kolorektaler Tumore verantwortlich sind. |
Teilprojekt 4: PD Dr. M. Kloor - Abteilung für Angewandte Tumorbiologie, Pathologisches Institut - Teilprojekt 4 führt für alle eingeschlossenen Patienten bzw. Tumorproben eine Mikrosatelliten- instabilitäts-Analyse durch analysiert die klinische Bedeutung der Mikrosatelliteninstabilität für das Metastasierungsverhalten kolorektaler Karzinome. |
Teilprojekt 5: Prof. Dr. P. Beckhove - Arbeitsgruppe Translationale Immunologie, DKFZ - Teilprojekt 5 untersucht die T-zelluläre Immunabwehr beim kolorektalen Karzinom sowie insbesondere das therapeutische Potential von T-Zellen, die auf Antigene tumor-initiierender Zellen (TIC) reagieren. |
Teilprojekt 6: PD Dr. M. Schneider - Chirurgische Klinik - Teilprojekt 6 analysiert die Bedeutung molekularer Sauerstoff-Sensoren für die Metastasierung kolorektaler Karzinome sowie daraus erwachsende, therapeutische Konsequenzen. |
Teilprojekt 7: Dr. N. Halama, Dr. I. Zörnig, Prof. D. Jäger - Abteilung Medizinische Onkologie, NCT - Teilprojekt 7 untersucht die klinische Bedeutung der lokalen und systemischen immunologischen Mirkoumgebung bei Patienten mit hepatisch metastasiertem kolorektalem Karzinom. |
Teilprojekt 8: Prof. Dr. H. Schulze-Bergkamen - Abteilung Medizinische Onkologie, NCT - Teilprojekt 8 beleuchtet die Rolle von anti-apoptotischen Bcl-2-Proteinen bei der Entstehung und Progression von kolorektalen Karzinomen. |