Projekte der Arbeitsgruppe
Einleitung
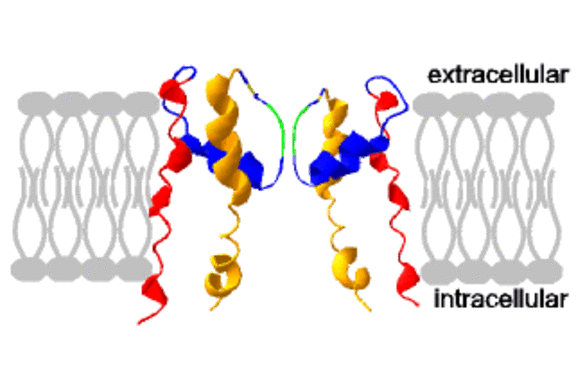
Viele Menschen leiden unter Herzrhythmusstörungen. Sie können harmlos sein, aber auch zu lebensbedrohlichen Situationen führen, besonders wenn noch andere Herzkrankheiten hinzukommen. Der durch kardiale Arrhythmien ausgelöste plötzliche Herztod ist für 15-20% aller natürlichen Todesfälle in den westlichen Ländern verantwortlich. Durch Erforschung der molekularen Entstehungsmechanismen kardialer Arrhythmien sollen in der Zukunft neue, kausale Behandlungskonzepte entwickelt werden (translationale Wissenschaft).
Die Herzinsuffizienz ist eine weitere bedeutende Erkrankung, unter der in Deutschland mehr als 2 Mio. Menschen leiden. Sie wird als dominierende Herz-Kreislauferkrankung des 21. Jahrhunderts betrachtet. Apoptose von Kardiomyozyten ist ein kritischer zellulärer Vorgang in der Entwicklung einer Herzinsuffizienz. Die Aufklärung eines mechanistischen Zusammenhangs zwischen kardialen Ionenkanälen und Apoptose wird zum Verständnis der zellbiologischen Mechanismen der Herzinsuffizienz beitragen. Aus diesen Ergebnissen können neue Strategien zur Prävention, Risikostratifikation und Therapie dieser Erkrankung abgeleitet werden.
Mutationsanalyse von Patienten mit erblichen Herzrhythmusstörungen
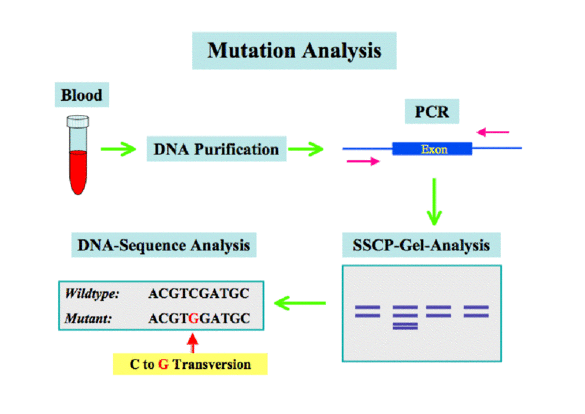
Patienten mit einer familiären Form einer ventrikulären Herzrhythmusstörung und mit sporadischem Auftreten von lebensbedrohlichen kardialen Arrhythmien werden in der Regel invasiv untersucht, um mit Hilfe der diagnostischen Koronarangiographie und Ventrikulographie primäre Ursachen (koronare Herzerkrankung, Kardiomyopathien) zu erfassen. Zur weiteren Abklärung wird häufig auch eine invasive elektrophysiologische Untersuchung durchgeführt, um Aussagen über die Genese und Prognose der Rhythmusstörung machen zu können. Im Rahmen eines von uns durchgeführten Screenings von Patienten konnten wir Mutationen in Ionenkanal-Genen identifizieren, die teilweise bisher nicht beschrieben wurden. Zur Analyse wurde genomische DNA aus Blutproben von Patienten isoliert und die Exon-Sequenzen wichtiger Ionenkanalgene mittels PCR und SSCP Analyse überprüft. Die amplifizierten PCR Produkte mit Auffälligkeiten wurden isoliert und nach Klonierung der Fragmente durch DNA Sequenzanalyse überprüft. Parallel wurden die für eine funktionelle Analyse der Mutationen erforderlichen cDNAs wichtiger Ionenkanäle (KCNQ1, KCNH2, KCNE1, KCNE2) aus menschlicher cDNA isoliert, sequenziert und in Expressionsvektoren kloniert. Anschließend können die mutierten Kanäle in Zellsystemen exprimiert und elektrophysiologisch charakterisiert werden.
Blockade kardialer Kaliumkanäle - Effiziente antiarrhythmische Therapie mit Risiko
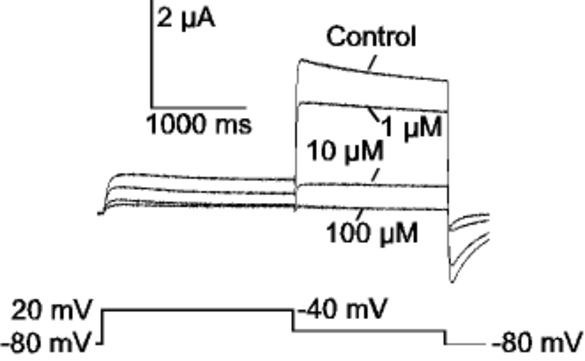
Inhibition des kardialen IKr (hERG)-Kaliumstroms ist Ziel der Therapie mit Klasse III-Antiarrhythmika. Eine übermäßige Inhibition dieses Stroms kann jedoch zu dem erworbenen Langen QT-Syndrom führen und einen plötzlichen Herztod zur Folge haben. Diese Erkrankung ist nicht nur als Nebenwirkung der Therapie mit Klasse III-Antiarrhythmika bekannt, sondern wurde auch als unerwünschter Effekt von nicht antiarrhythmischen Substanzen (z. B. Psychopharmaka, Antibiotika, Zytostatika) nachgewiesen. In diesem Projekt werden am klonierten hERG-Kaliumkanal Daten über die chemischen und biophysikalischen Eigenschaften von Medikamenten, die für erworbenes Langes QT Syndrom verantwortlich sind, erhoben. Sie sind die Grundlage für präklinische in vitro- und in silico-Testverfahren zur Risikoevaluation in der pharmazeutischen Forschung und Entwicklung, die wir in Kooperation mit dem Forschungszentrum Karlsruhe entwickeln.
Antiarrhythmische Gentherapie
Die Therapie von Herzrhythmusstörungen mit Medikamenten, Ablationsverfahren, Herzschrittmachern oder Defibrillatoren ist bei komplexen Arrhythmien teilweise nicht ausreichend. Für diese Fälle untersuchen wir in translationalen Ansätzen die Wirksamkeit von gentherapeutischen Ansätzen. Wir fokussieren unsere Arbeiten derzeit auf das Vorhofflimmern, die häufigste aller anhaltenden Herzrhythmusstörungen, sowie auf ventrikuläre Tachykardien nach Herzinfarkt.
Kardiale Schrittmacher-Kanäle
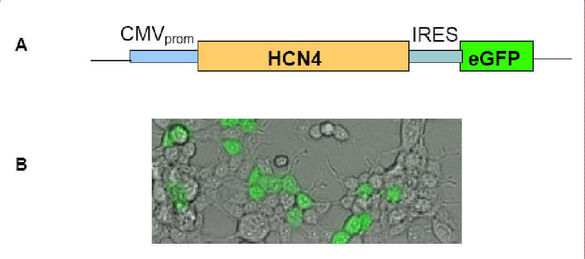
Die Sinusknotendysfunktion ist die häufigste Indikation für die Implantation eines elektrischen Herzschrittmachers. Gentherapie und Zelltransplantation stellen aktuelle Therapiekonzepte zur Restitution kardialer Funktionsstörungen dar. Eines unserer Ziele ist es aus genetisch modifizierten mesenchymalen Stammzellen (MSC) ein biologisches Herzschrittmachersystem zu etablieren, welches der physiologischen Sinusknotenfunktion deutlich näher kommen sollte als elektrische Herzschrittmachersysteme. Dazu sollen adulte MSC eingesetzt werden, die nach viraler Transduktion den Schrittmacherkanal HCN4 exprimieren, der als molekulares Korrelat des “funny“ Strom (If) für die Schrittmacheraktivität im Sinusknoten verantwortlich ist. In einem zweiten Ansatz sollen MSC “in-vitro“ zur kardiomyogenen Differenzierung angeregt werden, um schrittmacherartige Zellen zu generieren.
Darüber hinaus haben wir mit Hilfe der SSCP Analyse bei Patienten mit Sinusknotendysfunktion ohne strukturelle Herzerkrankung unterschiedliche Mutationen im HCN4-Gen identifiziert. Da weltweit bisher erst wenige HCN4 Mutationen beschrieben wurden ist es von großem Interesse die neuen Mutationen funktionell zu charakterisieren und zu beschreiben. Wir haben daher die in unterschiedlichen Exons des HCN4 Gens auftretenden Mutationen in Plasmidvektoren kloniert und durch DNA Sequenzanalyse genetisch identifiziert. Zur genauen Charakterisierung führen wir nach Transfektion und Expression in HEK-Zellen elektrophysiologische Messungen durch.
Proteomische Analyse makromolekularer Ionenkanal-Komplexe im Herzen
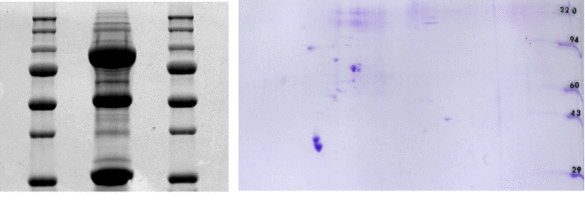
Aktuelle Erkenntnisse aus der Proteomik zeigen, dass die Regulation von kardialen Ionenkanälen und damit die Steuerung des Herzrhythmus nicht isoliert auf das Kanalprotein selbst zurückzuführen ist. Arrhythmogenese wird vielmehr als ein multifaktorielles Geschehen angesehen, in dessen Zentrum sich makromolekulare Proteinkomplexe befinden. Diese setzen sich zusammen aus dem Ionenkanal-Protein, akzessorischen beta-Untereinheiten, Proteinkinasen und –Phosphatasen sowie Adapter-, Verankerungs- und Signaltransduktionsmolekülen. Mithilfe von proteomischen Methoden wie Pull-down Assays und zweidimensionaler Gelelektrophorese (siehe Abbildung), Yeast-two-hybrid Screening und Massenspektrometrie identifizieren wir neue Komponenten von Proteinkomplexen im Herzen. Die Funktion der neu identifizierten Proteine wird mittels elektrophysiologischer Techniken (Patch Clamp, Doppelelektroden Voltage Clamp) charakterisiert.
Antiarrhythmische Therapie durch Modulation von Zwei-Porendomänen-Kaliumkanälen
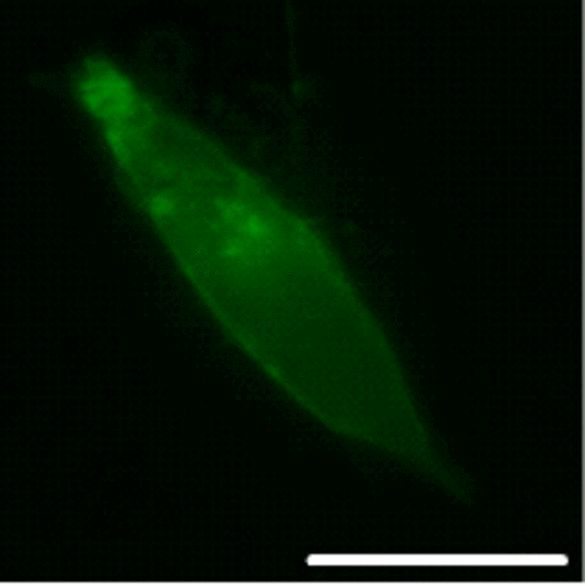
Die komplexe Regulation der Zwei-Porendomänen-Kaliumkanäle (K2P) liefert einen entscheidenden Beitrag zur Plastizität kardialer Erregbarkeit und bietet wertvolle therapeutische Angriffspunkte. Eine Erhöhung ihrer Leitfähigkeit hat zur Folge, dass das Membranpotential unter die Aktionspotential-Schwelle abgesenkt und das proarrhythmische Potential im Herzen reduziert wird. Dieses Projekt zielt darauf ab, die Modulation kardialer K2P-Kanäle durch Proteinkinasen zu charakterisieren und intrazelluläre Signaltransduktionsmechanismen im Detail zu entschlüsseln.
Ionenkanal-abhängige Apoptose im Herzen: Herzinsuffizienz als Cannelopathy?
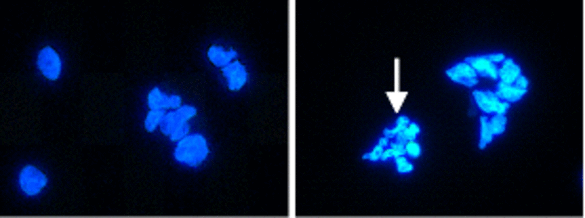
Apoptose von Kardiomyozyten ist sowohl in frühen Stadien der myokardialen Dysfunktion als auch für den progressiven Zellverlust bei manifester Herzinsuffizienz von Bedeutung. Kaliumselektive Ionenkanäle sind seit kurzer Zeit als Regulatoren von Apoptose bekannt: Sowohl Aktivierung als auch Inhibition einer Kalium-Leitfähigkeit kann in Abhängigkeit vom zellulären Umfeld pro-apoptotisch wirken. Hier charakterisieren wir Ionenkanal-abhängige Apoptose in Kardiomyozyten und ihre physiologische, pathologische und therapeutische Relevanz.