- Arbeitsgruppen
- Klinisches Studienzentrum
- Sektion Kardio-Onkologie
- Section of Molecular and Translational Cardiology
- Sektion Internistische Intensivmedizin
- Klaus-Tschira-Institut für Computerkardiologie
- Heisenberg Professur für Immunkardiologie (W3)
- Heisenberg professorship for mRNA metabolismus
- Jun. Professur für Künstliche Intelligenz in der Kardiovaskulären Medizin
- Pregnancy Heart Team: Kardiologie der Schwangerschaft
- DZHK-Standort Heidelberg/Mannheim
- Heidelberg CardioBiobank (HCB)
- Scientific Management and Coordination Unit (SMCU)
AG Interventionelle Kadiologie
Herzklappeninterventionen
In der Klinik für Kardiologie, Angiologie und Pneumologie der Universitätsklinik Heidelberg besteht ein sehr aktives und großes Klappeninterventionsprogramm, das wissenschaftlich begleitet wird. Es werden sowohl transfemorale, als auch transaxilläre Aortenklappenimplantationen durchgeführt, einschließlich spezieller Indikationen, wie z.B. valve-in-valve Implantationen. Zusätzlich werden MitraClips implantiert, insbesondere bei schwerer Herzinsuffizienz. Die wissenschaftliche Begleitung der klinischen Anwendungen hat verschiedene Schwerpunkte gesetzt:
Ein wichtiger Bereich ist die Charakterisierung neuer Implantationstechniken, sowie Charakterisierung technischer Innovationen bei den Klappensystemen. Dazu gehört auch der Einsatz von off-label Anwendungen zur Verbesserung des Implantationsablaufs und deren Beurteilung. Ein weiterer Schwerpunkt ist die Evaluation der Lebensqualität nach transfemoraler Aortenklappenimplantation, sowie Erkennung von Determinanten einer fehlenden positiven Reaktion. Schließlich werden die Bedeutung und der Einfluss von Biomarkern bei Klappeninterventionen untersucht.
Bei den MitraClip Implantationen wird als Schwerpunkt die Gruppe der Patienten mit schwerer Herzinsuffizienz charakterisiert. Insbesondere wird das reverse remodeling nach MitraClip Implantation untersucht. Auch hier werden technische Aspekte im Implantationsablauf, sowie die Durchführbarkeit des Eingriffs bei Hoch-Risiko Patienten evaluiert.
Eingriffe an Herzklappen
Auswahl einiger Publikationen zu Herzklappen:
- Pleger ST, Chorianopoulos E, Krumsdorf U, Katus HA, Bekeredjian R. Percutaneous edge-to-edge repair of mitral regurgitation as a bail out strategy in critically ill patients. J Invas Cardiol: 2013 Feb;25(2):69-72.
- Korosoglou G, Gitsioudis G, Krumsdorf U, Hosch W, Kauczor H, Chorianopoulos E, Katsu HA, Bekeredjian R. Objective Quantification of Aortic Valvular Structures by Cardiac Computed Tomography Angiography in Patients Considered for Transcatheter Aortic Valve Implantation. Cath Cardiovasc Interv 2013;81:148-59.
- Chorianopoulos E, Krumsdorf U, Pleger ST, Katus HA, Bekeredjian R. Late occurrence of bradyarrhythmias after TAVI with the selfexpanding CoreValve® aortic bioprosthesis. Clin Res Cardiol 2012;101:349-55.
- Chorianopoulos E, Krumsdorf U, Pleger ST, Katus HA, Bekeredjian R. Improved procedural results after CoreValve implantation with the new AccuTrak delivery system. J Interv Cardiol 2012;25:174-9.
- Krumsdorf U, Chorianopoulos E, Kallenbach K, Karck M, Katus HA, Bekeredjian R. C-reactive protein kinetics and its prognostic value after transfemoral aortic valve implantation. J Invas Card 2012;24:282-6.
- Pleger ST, Mereles D, Schulz-Schönhagen M, Krumsdorf U, Chorianopoulos E, Rottbauer W, Katus HA, Bekeredjian R. Acute Safety and 30 Day Outcome after percutaneous Edge-to-edge Repair of Mitral Regurgitation in very high risk Patients. Am J Cardiol 2011;108):1478-82.
- Bekeredjian R, Krumsdorf U, Chorianopoulos E, Kallenbach K, Karck M, Katus HA, Rottbauer W. Usefulness of Percutaneous Aortic Valve Implantation to Improve Quality of Life in Patients > 80 Years of Age. Am J Cardiol 2010; 106:1777-81.
- Bekeredjian R, Grayburn PA. Valvular Heart Disease - Aortic Regurgitation. Circulation 2005;112:125-134.
- Bekeredjian R, Frey N. Encyclopedia of Molecular Mechanisms of Disease: Aortic Valve Regurgitation. Springer 2009; ISBN 978-3540671367
Therapeutische Kontrastmittel
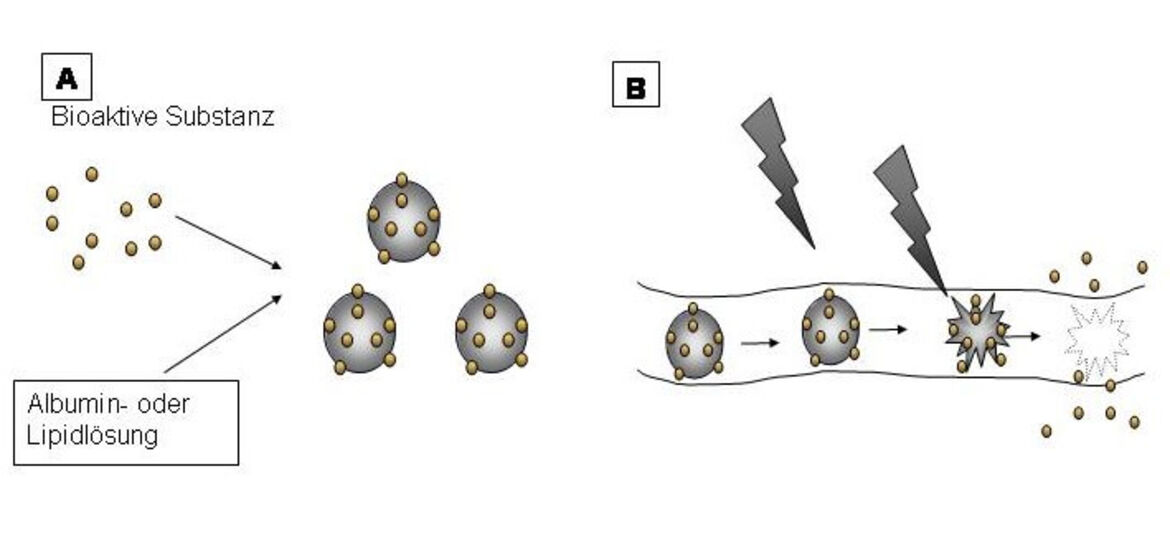
Gas gefüllte Mikrosphären (Microbubbles) haben sich in den letzten Jahren als Kontrastmittel für die Ultraschalldiagnostik bewährt. Ihre Kontrastmitteleigenschaft basiert auf ihrer Fähigkeit bei spezifischen Resonanzfrequenzen zu oszillieren. Je nach Ultraschallenergie können die Oszillationen bis zur Zerstörung der Mikrosphären gesteigert werden. Wir haben uns diese Eigenschaft zu Nutze gemacht, um Mikrosphären mit bioaktiven Substanzen zu beladen, diese intravenös in Versuchstieren zu infundieren und mit Ultraschall in einem Zielorgan (z.B. Herz) zu zerstören (siehe Abbildung). Dieses ermöglicht eine Transfektion des Zielorgans durch ein Transgen oder eine erhöhte Aufnahme von Medikamenten.
Förderung:
BioFuture Nachwuchsförderung des Bundesministeriums für Bildung und Forschung (2005-2009).
Auswahl einiger Publikationen zu therapeutischen Kontrastmitteln:
- Tinkov S, Winter G, Coester C, Bekeredjian R. New doxorubicin-loaded phospholipid microbubbles for targeted tumor therapy: Part I--Formulation development and in-vitro characterization. J Control Release. 2010;143:143-50.
- Geis NA, Mayer CR, Kroll RD, Hardt SE, Katus HA, Bekeredjian R. Spatial Distribution Of Ultrasound Targeted Microbubble Destruction Increases Cardiac Transgene Expression But Not Capillary Permeability. Ultrasound Med Biol. 2009;35:1119-26.
- Mayer CR, Geis NA, Katus HA, Bekeredjian R. Ultrasound targeted microbubble destruction for drug and gene delivery. Expert Opin. Drug Deliv. 2008;5(10):1-18.
- Müller OJ, Schinkel S, Kleinschmidt JA, Katus HA, Bekeredjian R. Augmentation of AAV-Mediated Cardiac Gene Transfer after Systemic Administration in Adult Rats. Gene Therapy. 2008;15:1558-65.
- Mayer CR, Bekeredjian R. Ultrasonic gene and drug delivery to the cardiovascular system. Adv Drug Deliv Rev. 2008;60:1177-92.
- Bekeredjian R, Kroll RD, Fein E, Tinkov S, Coester C, Winter G, Katus HA, Kulaksiz H. Ultrasound targeted microbubble destruction increases capillary permeability in hepatomas. Ultrasound Med Biol 2007; 33:1592-8.
- Muller OJ, Katus HA, Bekeredjian R. Targeting the heart with gene therapy-optimized gene delivery methods.Cardiovasc Res 2007;73:453-62.
- Chen S, Ding JH, Bekeredjian R, Yang BZ, Shohet RV, Johnston SA, Hohmeier HE, Newgard CB, Grayburn PA. Efficient gene delivery to pancreatic islets with ultrasonic microbubble destruction technology. Proc Natl Acad Sci U S A 2006;103:8469-74.
- Bekeredjian R, Katus HA, Kuecherer HF. Therapeutic use of ultrasound targeted microbubble destruction: a review of non-cardiac applications. Ultraschall Med 2006;27:134-40.
- Bekeredjian R, Chen S, Grayburn PA, Shohet RV. Augmentation of cardiac protein delivery using ultrasound targeted microbubble destruction. Ultrasound Med Biol 2005;31:687-91.
- Bekeredjian R, Grayburn PA, Shohet RV. Use of ultrasound contrast agents for gene or drug delivery in cardiovascular medicine. J Am Coll Cardiol 2005;45:329-35.
- Bekeredjian R, Chen S, Pan W, Grayburn PA, Shohet RV. Effects of ultrasound-targeted microbubble destruction on cardiac gene expression. Ultrasound Med Biol 2004;30:539-43.
- Bekeredjian R, Shohet RV. Cardiovascular gene therapy: angiogenesis and beyond. Am J Med Sci 2004;327:139-48.
- Bekeredjian R, Chen S, Frenkel PA, Grayburn PA, Shohet RV. Ultrasound-targeted microbubble destruction can repeatedly direct highly specific plasmid expression to the heart. Circulation 2003;108:1022-6.
Phänotypisierung von Mäusen
Seit 2009 "Head of Cardiovascular Screen" an der Deutschen Mausklinik in Neuherberg bei München.
Auswahl einiger Publikationen zur Phänotypisierung von Mäusen:
- Schoensiegel F, Ivandic B, Geis NA, Schrewe A, Katus HA, Bekeredjian R. High Throughput Echocardiography in Conscious Mice: Training and Primary Screens.
- Ultraschall Med 2011;32 Suppl 1:S124-9.
- Schoensiegel F, Bekeredjian R, Schrewe A, Weichenhan D, Frey N, Katus HA, Ivandic BT. Atrial natriuretic peptide and osteopontin are useful markers of cardiac disorders in mice.
- Comp Med 2007;57:546-53.
- Morgan H, Beck T, Blake A, Gates H, Adams N, Debouzy G, Leblanc S, Lengger C, Maier H, Melvin D, Meziane H, Richardson D, Wells S, White J, Wood J; EUMODIC Consortium, de Angelis MH, Brown SD, Hancock JM, Mallon AM. EuroPhenome: a repository for high-throughput mouse phenotyping data. Nucleic Acids Res 2010;38):D577-85.
- Fuchs H, Gailus-Durner V, Neschen S, Adler T, Afonso LC, Aguilar-Pimentel JA, Becker L, Bohla A, Calzada-Wack J, Cohrs C, Dewert A, Fridrich B, Garrett L, Glasl L, Götz A, Hans W, Hölter SM, Horsch M, Hurt A, Janas E, Janik D, Kahle M, Kistler M, Klein-Rodewald T, Lengger C, Ludwig T, Maier H, Marschall S, Micklich K, Möller G, Naton B, Prehn C, Puk O, Rácz I, Räss M, Rathkolb B, Rozman J, Scheerer M, Schiller E, Schrewe A, Steinkamp R, Stöger C, Sun M, Szymczak W, Treise I, Vargas Panesso IL, Vernaleken AM, Willershäuser M, Wolff-Muscate A, Zeh R, Adamski J, Beckers J, Bekeredjian R, Busch DH, Eickelberg O, Favor J, Graw J, Höfler H, Höschen C, Katus H, Klingenspor M, Klopstock T, Neff F, Ollert M, Schulz H, Stöger T, Wolf E, Wurst W, Yildirim AÖ, Zimmer A, Hrabě de Angelis M. Innovations in phenotyping of mouse models in the German Mouse Clinic. Mamm Genome. 2012;23(9-10):611-22.
- Ivandic BT, Mastitsky SE, Schönsiegel F, Bekeredjian R, Eils R, Frey N, Katus HA, Brors B. Whole-genome analysis of gene expression associates the ubiquitin-proteasome system with the cardiomyopathy phenotype in disease-sensitized congenic mouse strains. Cardiovasc Res. 2012;94:87-95.
- Arbeitsgruppen
- Klinisches Studienzentrum
- Sektion Kardio-Onkologie
- Section of Molecular and Translational Cardiology
- Sektion Internistische Intensivmedizin
- Klaus-Tschira-Institut für Computerkardiologie
- Heisenberg Professur für Immunkardiologie (W3)
- Heisenberg professorship for mRNA metabolismus
- Jun. Professur für Künstliche Intelligenz in der Kardiovaskulären Medizin
- Pregnancy Heart Team: Kardiologie der Schwangerschaft
- DZHK-Standort Heidelberg/Mannheim
- Heidelberg CardioBiobank (HCB)
- Scientific Management and Coordination Unit (SMCU)