- Sektion Sepsis & Systemische Inflammation
- Sektion Notfallmedizin
- Sektion Schmerzmedizin
- Forschungsschwerpunkte
-
Arbeitsgruppen
- Airwaymanagement
- Akutes respiratorisches Versagen, lungenprotektive Beatmung und extrakorporale Eliminationsverfahren
- Antiinfektive Therapie und Antibiotic Stewardship
- Epigenomik der Sepsis
- Gehirn: Kognition, Stress und Inflammation
- Hämostaseologie, Hämodynamik und septische Immunmodulation
- Immunmetabolismus & Epigenetik in (systemischen) Immunreaktionen
- Neue diagnostische Wege zur Infektionsdetektion in der induzierten Immunsuppression
- Nosokomiale Infektionen und fungale Immunität
- Translational Research in Pain
Forschung
AG Epigenomik der Sepsis
Forschungsschwerpunkt
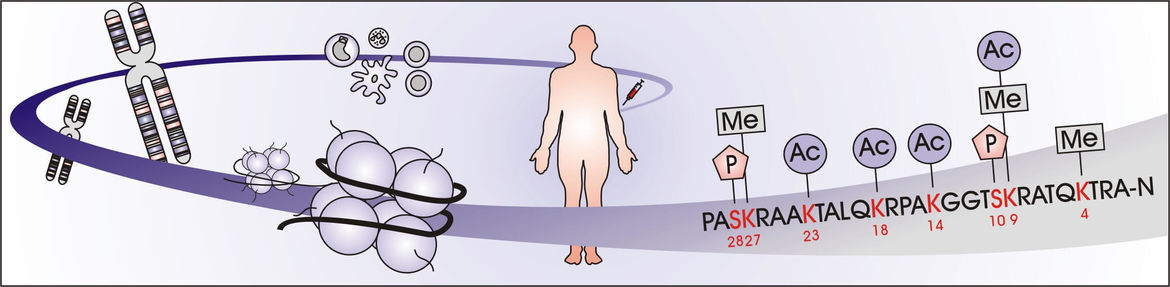
Epigenetische Regulationsmechanismen ermöglichen die Anpassung zellulärer Steuerungs- und Syntheseprozesse auf äußere Veränderungen „oberhalb“ (=„epi“)“ des eigentlichen genetischen Codes. Die Arbeitsgruppe Epigenomik der Sepsis analysiert die Veränderungen solcher Mechanismen im Kontext einer gestörten Immunität von Patienten, die an einer Sepsis erkrankt sind oder die nach einer Operation ein hohes Risiko für sekundäre infektiologische Komplikationen aufweisen.
Arbeitsgruppenleiter
Wiss. Mitarbeiter/-innen
-

Rui Dos Santos Pereira
-

Dr. med. Jan Niklas Thon
Doktoranden/-innen
Sarah Frick
Katrin Lenz
Natalie Stempel
Aktuelle Projekte
- Sepsis-assoziierte Immundysfunktion in vulnerablen Patientenkollektiven: Inzidenz und klinisches Erscheinungsbild der Sepsis können erheblich zwischen verschiedenen Patientenkollektiven variieren, was das klinische Management erschwert. Ein Ziel der Arbeitsgruppe ist es daher, Charakteristika der Immundysfunktion Sepsis und deren Folgen für die Behandlung von Patienten zu analysieren, die basierend auf ihrer Grunderkrankung ein hohes Risiko für infektiologische Komplikationen aufweisen. Dazu gehören z.B. Patienten mit invasiver Beatmung aufgrund eines spinalen Querschnitts oder immunsupprimierte Patienten nach Organtransplantation.
- Epigenetische Regulationsmechanismen als Grundlage der Sepsis-assoziierten Immundysfunktion: Klinisch-experimentelle Studien der Arbeitsgruppe beschäftigen sich mit übergeordneten Regulationsmechanismen, die den Prozess der Antigenpräsentation in zirkulierenden Immunzellen beeinflussen. Hierbei wird ein Schwerpunkt auf die Rolle des übergeordneten Regulatorproteins CCCTC-binding factor (CTCF) in der Sepsis-assoziierten Immundysfunktion gelegt.
- Epigenetische Mechanismen als Determinante der Funktionalität antigenpräsentierender Zellen nach immunologischer Stimulation: Bisherige Analysen der Arbeitsgruppe konnten zeigen, dass eine Sepsis in zirkulierenden Immunzellen zu spezifischen Veränderungen der Chromatinlandschaft führt. Distinkte Auslöser dieser epigenetischen „Sepsis-Signaturen“ konnten aufgrund der Komplexität des Krankheitsbildes mit vielfältigen immunologischen Signalüberlagerungen bislang jedoch noch nicht identifiziert werden. In einem experimentellen Ansatz soll daher der Einfluss unterschiedlicher vermuteter Triggersubstanzen auf das epigenetische Profil antigenpräsentierender Zellen näher untersucht werden.
Förderungen
- BBraun Stiftung
- Heidelberger Stiftung Chirurgie
- Sektion Sepsis & Systemische Inflammation
- Sektion Notfallmedizin
- Sektion Schmerzmedizin
- Forschungsschwerpunkte
-
Arbeitsgruppen
- Airwaymanagement
- Akutes respiratorisches Versagen, lungenprotektive Beatmung und extrakorporale Eliminationsverfahren
- Antiinfektive Therapie und Antibiotic Stewardship
- Epigenomik der Sepsis
- Gehirn: Kognition, Stress und Inflammation
- Hämostaseologie, Hämodynamik und septische Immunmodulation
- Immunmetabolismus & Epigenetik in (systemischen) Immunreaktionen
- Neue diagnostische Wege zur Infektionsdetektion in der induzierten Immunsuppression
- Nosokomiale Infektionen und fungale Immunität
- Translational Research in Pain