MRD-Labor
Anforderungsschein für MRD-Diagnostik (PDF)
Die akute lymphatische Leukämie (ALL) ist mit einem Anteil von 30 - 35% die häufigste aller malignen Erkrankungen im Kindesalter. Der Einsatz intensiver Polychemotherapie nach zeitlich festgelegten Schemata führt bei ~ 98 % der betroffenen Kinder bereits nach 4 Wochen zu einer kompletten klinischen Remission, d. h., die Leukämie-Zellzahlen fallen unter die Nachweisgrenzen konventioneller diagnostischer Verfahren (< 1-5 % maligne Zellen im Knochenmark). Eine Reduktion der malignen Zellpopulation um ca. zwei Zehnerpotenzen bedeutet jedoch, dass noch ein erheblicher Anteil residueller Leukämiezellen im Patienten vorhanden sein kann, ohne dass diese mit gängigen Nachweismethoden (Morphologie, Imunophänotypisierung, Zytogenetik und Southern Blot Analyse) identifiziert werden können.
Der Einsatz der „real-time“ quantitativen PCR-Technologie (RQ-PCR) ermöglicht eine sehr viel sensitivere Erfassung minimaler residueller Leukämiezellen (Detektion minimaler Resterkrankung = minimal residual disease, MRD), so dass durch die Analyse geeigneter DNA-Marker in der Regel eine unter zehntausend Leukämiezellen (10-4) oder gar unter einhunderttausend (10-5) normaler Lymphozyten detektiert werden kann. Als Markersystem werden Klon-spezifische Immunglobulin (Ig)- und T-Zell-Rezeptor (TCR) Genrearrangements verwendet, wobei für jeden Patienten im Idealfall zwei unterschiedliche Gensonden mit einer Nachweisgrenze von jeweils ≤10-4 zur Anwendung kommen.
Der molekulardiagnostische Nachweis minimaler Resterkrankung mittels RQ-PCR ist somit von wesentlichem prognostischen Wert, um eine möglichst präzise Abschätzung des individuellen Rezidivrisikos, sowie eine risikoadaptierte Behandlung des Patienten zu ermöglichen.
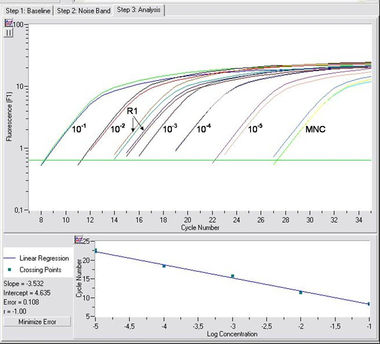
Bild: RQ-PCR-Experiment eines IgH-Rearrangements (mittels Sonde) mit einer Nachweisgrenze von 10-5 und der Messung eines Therapiezeitpunkts (R1); MNC (mononuklearer Zellhintergrund).
Mitarbeiter/-innen
Laborleitung
-

Dr. phil. nat. Rolf Köhler
Schwerpunkt
Leukämie und MRD-Diagnostik
Med.-techn. Assistenten/-innen
Med.-techn. Laborassistenten/-innen
Ehemalige Mitarbeiter/-innen
Scientists:
Dr. T. Seriu
Dr. M. Nakao
Dr. T. Flohr
MTAs:
Simone Busenbender
Kirsten Linsmeier
Cornelia Rütz
Ivonne Schmitt
Yvonne Yeboah
Heike Kuzan
Daniela Siragusa
Nicole Schatz
Kooperationspartner
Prof. Dr. M. Schrappe (ALL-BFM-Studie 95 + 2000) Klinik für Allgemeine Pädiatrie, Universität Kiel
Prof. Dr. D. Hölzer (GMALL 06/99+ 07/03-Studie) Med. Klinik II, Universität Frankfurt
Prof. Dr. M. Kneba (GMALL 06/99+ 07/03-Studie) Med. Klinik II, Universität Kiel
ESG-MRD-ALL (European Study Group on Minimal Residual Disease Detection in Childhood acute lymphoblastic Leukaemia)
Links
www.kinderkrebsinfo.de/erkrankungen/leukaemien
www.kompetenznetz-leukaemie.de
Ausgewählte Publikationen
van Dongen JJ, Seriu T, Panzer-Grumayer ER, Biondi A, Pongers-Willemse MJ, Corral L, Stolz F, Schrappe M, Masera G, Kamps WA, Gadner H, van Wering ER, Ludwig WD, Basso G, de Bruijn MA, Cazzaniga G, Hettinger K, van der Does-van den Berg A, Hop WC, Riehm H, Bartram CR: Prognostic value of minimal residual disease in acute lymphoblastic leukaemia in childhood. Lancet. 1998 352: 1731
Pongers-Willemse M.J., Seriu T., Stolz F., Corral L., Gameiro P., Pisa P., Gonzales M., Bartram C.R., Panzer-Grümayer E.R., Biondi A., San Miguel J.F., van Dongen J.J.M.: Primers and protocols for standardized detection of minimal residual disease in acute lymphoblastic leukemia using immunoglobulin and T cell receptor gene rearrangements and TAL1 deletions as PCR targets. Leukemia 13, 110-118, 1999.
Nakao M., Janssen J.W.G., Flohr T., Bartram C.R.: Rapid and reliable quantification of minimal residual disease in acute lymphoblastic leukemia using rearranged immunoglobulin and T-cell receptor loci by LightCycler technology. Cancer Res. 60, 3281-3289, 2000.
Biondi A., Valsecchi M.G., Seriu T., D’Aniello E., Willemse M.P., Fasching K., Pannunzio A., Gadner H., Schrappe M., Kamps W.A., Bartram C.R., van Dongen J.J.M., Panzer-Grümayer E.R.: Molecular detection of minimal residual disease is a strong predictive factor of relapse in childhood B-lineage acute lymphoblastic leukemia with medium risk features. A case control study of the International BFM-Study Group. Leukemia 14, 1939-1943, 2000.
Willemse M.J., Seriu T., d'Aniello E., Hop W.C.J., Panzer-Grümayer E.R., Biondi A., Schrappe M., Kamps W.A., Masera G., Gadner H., Riehm H., Bartram C.R., van Dongen J.J.M.: Detection of minimal residual disease identifies differences in treatment response between T-ALL and precursor-B-ALL. Blood 99, 4386-4393, 2002.
Brüggemann M, Raff T, Flohr T, Gökbuget N, Nakao M, Droese J, Lüschen S, Pott C, Ritgen M, Scheuring U, Horst HA, Thiel E, Hoelzer D, Bartram CR, Kneba M; German Multicenter Study Group for Adult Acute Lymphoblastic Leukemia. Clinical significance of minimal residual disease quantification in adult patients with standard-risk acute lymphoblastic leukemia. Blood. 2006 Feb 1;107(3):1116-23.
van der Velden VH, Cazzaniga G, Schrauder A, Hancock J, Bader P, Panzer-Grumayer ER, Flohr T, Sutton R, Cave H, Madsen HO, Cayuela JM, Trka J, Eckert C, Foroni L, Zur Stadt U, Beldjord K, Raff T, van der Schoot CE, van Dongen JJ; European Study Group on MRD detection in ALL (ESG-MRD-ALL). Analysis of minimal residual disease by Ig/TCR gene rearrangements: guidelines for interpretation of real-time quantitative PCR data. Leukemia. 2007 Apr;21(4):604-11.
Flohr T., Schrauder A., Cazzaniga G., Panzer-Grümeyer R., van der Velden V., Fischer S., Stanulla M., Basso G., Niggli F.K., Schäfer B., Sutton R., Koehler R., Zimmermann M., Valsecchi M.G., Gadner H., Masera G., Schrappe M., van Dongen J.J.M., Biondi A., Bartram C.R.: Minimal residual disease – directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP – BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia 22, 771-782, 2008
Schwarz A.K., Stanulla M., Cario G., Flohr T., Sutton R., Möricke A., Anker P., Stroun M., Welte K., Bartram C.R., Schrappe M., Schrauder A.: Quantification of free total plasma DNA and minimal residual disease detection in the plasma of children with acute lymphoblastic leukemia (ALL). Ann. Hematol. 88, 897-905, 2009
Conter V.*, Bartram C.R.*, Valsecchi M.G., Schrauder A., Panzer-Grümayer R., Möricke A., Arico M., Zimmermann M., Mann G., De Rossi G., Stanulla M., Locatelli F., Basso G., Niggli F., Barisone E., Henze G., Ludwig W.D., Haas O.A., Cazzaniga G., Koehler R., Silvestri D., Bradtke J., Parasole R., Beier R., van Dongen J.J.M., Masera G., Biondi A., Schrappe M.: Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia (ALL): results in 3184 patients of the AIEOP-BFM ALL 2000 study. Blood (in press) 2010




